昨日(9月27日),传奇生物宣布,日本厚生劳动省已批准Carvykti(西达基奥仑赛,Cilta-cel)用于治疗复发或难治性多发性骨髓瘤(R/R MM),包括无靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR)阳性T细胞输注治疗史的患者,以及既往接受过至少三线治疗,包括蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)和抗CD38单克隆抗体,且对末次治疗无响应或已复发的患者。
据了解,此次批准是基于一项开放标签、单臂、多中心的Ib/II期研究,用于评估Cilta-cel治疗复发或难治性多发性骨髓瘤成人患者的安全性和有效性。该研究纳入了97位既往接受过中位六线治疗,包括PI、IMiD和抗CD38单抗的患者。
研究结果显示,接受西达基奥仑赛一次性治疗的非日本人群显现了深度持久的缓解,总缓解率(ORR)达96.9%(95%CI,91.2-99.4 n=97)。值得注意的是,65名患者达到了严格意义上的完全缓解(sCR),严格意义上的完全缓解率达67%(95%CI,56.7-76.2),即治疗后无法通过影像学或其他检查观察到任何疾病体征或症状。在多发性骨髓瘤日本患者中观察到的疗效与非日本人群一致。在18个月的中位随访时间里,中位缓解持续时间(DOR)为21.8个月。
安全性方面,CARTITUDE-1研究在106名成人患者中进行了评估,包括97名非日本人群和9名日本患者。在接受西达基奥仑赛治疗的106名患者中,有105名(99.1%)患者出现了不良反应。最常见的不良反应包括细胞因子释放综合征(94.3%)、血细胞减少症(79.2%)、中性粒细胞减少症(75.5%)、血小板减少症(59.4%)、贫血(51.9%)、神经系统不良事件(39.6%)、感染(19.8%)和低丙球蛋白血症(11.3%)。
截至目前,西达基奥仑赛已在2个国家,1个区域获批上市。今年2月,西达基奥仑赛获得美国FDA批准,用于治疗复发/难治性多发性骨髓瘤(r/r MM)患者,5月,又获得欧盟委员会附条件上市许可,用于治疗既往接受过至少三种治疗,包括免疫调节药物、蛋白酶体抑制剂和抗CD38抗体,并且末次治疗出现疾病进展的复发或难治性多发性骨髓瘤(R/R MM)成人患者。现阶段,西达基奥仑赛在国内的上市申报正在推进中。
今年7月,金斯瑞发布公告称,截至2022年6月30日止,西达基奥仑赛季度产生贸易销售净额约2400万美元,约合人民币1.62亿元。
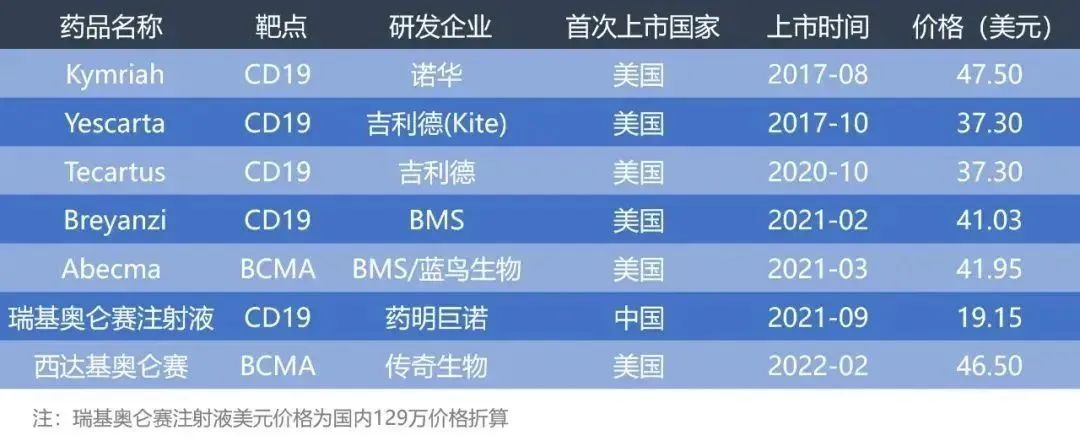
附全球范围内已上市CAR-T产品一览
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..