礼来(Eli Lilly and Company)今天宣布,美国FDA已加速批准Retevmo(selpercatinib)扩展适应症,不限癌种治疗携带RET基因融合的局部晚期或转移性实体瘤患者。这些患者接受前期系统性治疗后疾病进展或者没有其它满意的替代治疗选择。基于客观缓解率(ORR)和缓解持续时间(DOR),该适应症获得了加速批准。该适应症的继续批准可能取决于验证性临床试验中获得的临床获益证据。
美国FDA还授予Retevmo治疗RET基因融合的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的完全批准。FDA拓宽了Retevmo的适应症范围,纳入局部晚期疾病患者,并将2020年5月NSCLC加速批准转为完全批准。
这两项批准得到了关键性临床试验LIBRETTO-001数据的支持。在不限癌种患者队列中(n=41),Retevmo达到44%的总缓解率,中位缓解持续时间为24.5个月,67%的患者缓解持续时间超过6个月。不同癌症类型患者的疗效结果请见下图:
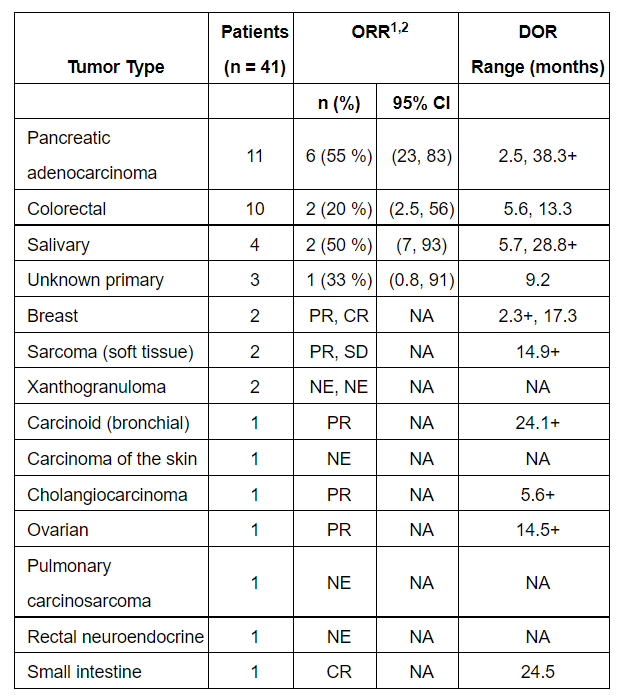
图片来源:参考资料[1]
在接受含铂化疗或初治RET融合阳性NSCLC患者中的疗效结果请见下表:
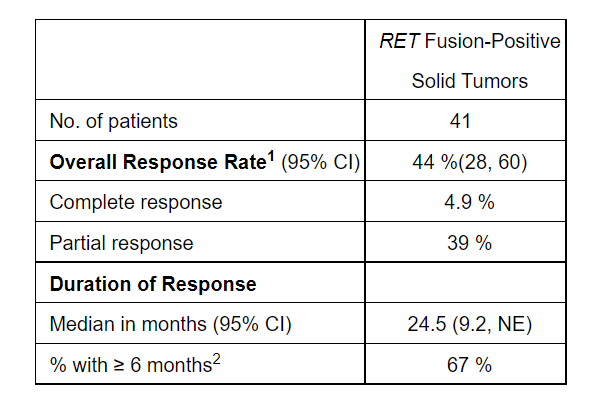
图片来源:参考资料[1]
“在LIBRETTO-001试验中,selpercatinib在RET驱动的多种癌症类型患者中表现出有临床意义和持久的缓解,包括需要新治疗选择的胰腺癌、结肠癌和其他癌症,”LIBRETTO-001合作研究者,MD安德森癌症中心的Vivek Subbiah博士说,“这些数据和美国FDA对不限癌种适应症的批准强调了对各种癌症类型患者进行常规、全面基因组检测的重要性。”
参考资料:
[1] FDA Approves Lilly's Retevmo® (selpercatinib), the First and Only RET Inhibitor for Adults with Advanced or Metastatic Solid Tumors with a RET Gene Fusion, Regardless of Type. Retrieved September 21, 2022, from https://www.prnewswire.com/news-releases/fda-approves-lillys-retevmo-selpercatinib-the-first-and-only-ret-inhibitor-for-adults-with-advanced-or-metastatic-solid-tumors-with-a-ret-gene-fusion-regardless-of-type-301630358.html
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..