7月21日,FiercePharma报道,罗氏制药业务负责人Bill Anderson在投资者会议上透露,Tecentriq(阿替利珠单抗)在肾癌辅助治疗的IMmotion010研究中未能达到主要终点。
Tecentriq是全球首款获批上市的PD-L1单抗,目前获批的适应症主要包括尿路上皮癌、非小细胞肺癌、小细胞肺癌、三阴性乳腺癌、肝细胞癌、黑色素瘤这几个瘤种,尚未在肾细胞癌适应症上拿到上市资格。
当前收获肾细胞癌适应症的PD1/PD-L1药物有3个,包括纳武利尤单抗、帕博利珠单抗、阿维鲁单抗。而且帕博利珠单抗在2021年11月和2022年1月先后获得FDA和EMA批准用于肾细胞癌的辅助治疗,是首款获得FDA批准辅助治疗肾细胞癌的免疫疗法。
IMmotion010研究是一项随机、双盲、安慰剂对照的III期临床试验,旨在评估Tecentriq用于手术切除后高复发风险的肾细胞癌患者的辅助治疗的疗效。此次失利也让Tecentriq与Keytruda在肾癌领域的交锋中拉开差距。
Tecentriq还有另外两项针对早期肝细胞癌和非小细胞肺癌辅助治疗的关键III期临床试验预计在今年完成。头颈部鳞状细胞癌的相关数据要推迟至2023年公布。
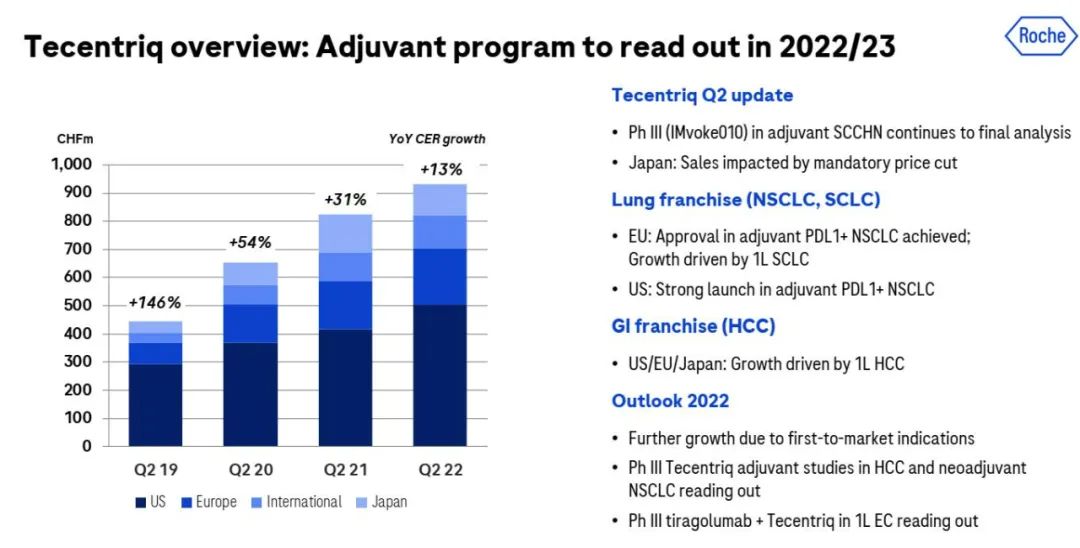
其中,III期IMbrave050研究主要评估Tecentriq联合Avastin(贝伐珠单抗) 作为辅助治疗相比主动监测在进行根治性手术切除或消融术后有高复发风险的HCC患者中的疗效和安全性。Bill Anderson表示,“由于在转移性疾病方面的胜利是‘明确的’,罗氏对于Tecentriq的辅助性肝癌治疗‘相当看好’。"
IMpower030研究主要评估Tecentriq与铂类化疗联合治疗术前可切除性早期NSCLC患者的疗效和安全性。今年3月,Opdivo(纳武利尤单抗)成为首个NSCLC新辅助治疗 PD-1/L1抑制剂,Tecentriq的IMpower030研究与Opdivo的CheckMate-816研究略有不同,Opdivo研究包括IB-III A期NSCLC,而Tecentriq的研究则涵盖II-III B期。
2021年10月,FDA批准Tecentriq用于PD-L1阳性II-IIIA期NSCLC手术和铂类化疗后的辅助治疗,这一具有里程碑意义的新适应症获批也是推动Tecentriq收入持续增长的主要因素之一。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..