到2021年,抗肿瘤药物从专利申请到产品上市的中位时间已经下降到了8.5年,这一数字在2020年还是9年。是什么一直在支持抗肿瘤新药的获批?全球抗肿瘤药物研发都有哪些新趋势 ?
全球新获批抗肿瘤药物数量达到历史新高、肿瘤临床试验数量达到历史最高水平、抗肿瘤新药的平均研发时间再次缩短……过去一年,全球的肿瘤药物研发领域又创下几项新纪录。
5月26日,IQVIA发布了新一年的《Global Oncology Trends 2022:OUTLOOK TO 2026》,让我们对2021年的全球抗肿瘤药物研发有了更全景的认识。
2021年,全球一共获批上市了30 种抗肿瘤新药,而在过去5年间一共获批了104种,自2012年以来获批了159种。在研发方面,抗肿瘤药物的临床试验数量比2016年增长56 %,主要集中在罕见癌症适应证上。
IQVIA统计,到2021年,肿瘤药物从专利申请到产品上市的中位时间下降到了8.5年,这一数字在2020年还是9年。
那么,是什么一直在支持抗肿瘤新药的获批?全球抗肿瘤药物研发都有哪些新趋势?
01 审评审批:抗肿瘤新药研发时间平均已降至8.5年,再创历史新低
在全球来看,从药品首次申请专利到上市之间的时间差对产品价值的实现至关重要,2021年,在肿瘤领域这一数字再创历史新低,降至8.5年。
那么,是什么加速了新药的获批?
IQVIA数据显示,2021年,FDA批准上市了22种抗肿瘤新药,其中突破性疗法、孤儿药政策、加速批准以及基于早期临床试验批准等加速审评审批的政策起到了关键作用。
IQVIA统计,2021年FDA批准了13个First-in-class抗肿瘤药物上市,创下历史新高,在新获批抗肿瘤药物中占比高达59%,而这一数字在过去五年的平均值为42%。
2021年还有16个抗肿瘤新药曾获得孤儿药称号。不过,这一数字并不高,因为在过去五年间,大多数肿瘤新药的开发都集中于罕见癌症,76%的抗肿瘤新药都曾获得1个或者多个孤儿药称号。
在加速批准方面,2021年有64%的抗肿瘤新药获得了加速批准,达到了历史最高水平,尽管其在获得标准批准之前还需要进一步的验证性临床试验。
2017-2021年,FDA各项加速审评审批政策下新药获批占比
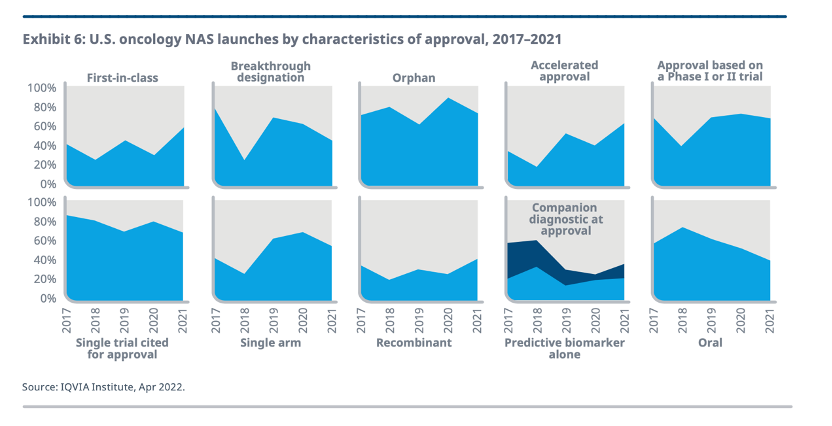
此外,2021年许多药物的批准是基于相对有限的试验证据,包括通过单一试验,或者在早期阶段试验中的数据。
2021年以来,备受市场关注的事件之一就是中国新药在FDA的审评审批。2022年3月,传奇生物的CAR-T细胞疗法获得FDA批准在美上市,IQVIA认为,这突显出中国抗肿瘤药物的研究在全球新药研发的作用越来越大。
但另一方面,几起“ODAC”事件和中国创新药在美遇阻的事件也显示出FDA对于临床试验的审批标准。2021年4月,FDA要求肿瘤药物咨询委员会(ODAC)重新评估PD-1抑制剂的加速批准适应证。共有9个PD-(L)1抑制剂的加速批准指征被撤回或撤销,其中大多数是公司在ODAC会议之前或之后自愿撤回的。
ODAC还通过对信达的信迪利单抗的审评审批强调了美国临床试验数据的重要性,只有中国的临床试验数据,不能代表在美国人群和美国医疗实践中的适用性。
当然这只是插曲,中国的创新药仍在向全球第一梯队迈进。IQVIA数据显示,在最近的五年中,中国推出了61个抗肿瘤新药,而2002-2016年只有41个。截至2021年,中国的抗癌新药上市总量达到了102个,已经位居全球第二,超过了法国、德国、意大利、西班牙和英国等五个欧洲国家的总和。
02 研发:罕见肿瘤研发成功率更高
全球对于罕见癌种的研发也在拉动整个抗肿瘤新药的研发。IQVIA统计,2021年肿瘤药物临床试验启动量达到历史最高水平,较2016年增长56 %,主要集中在罕见癌症适应证上,2021年启动的2335项临床试验中,有64%用于研发罕见癌症。
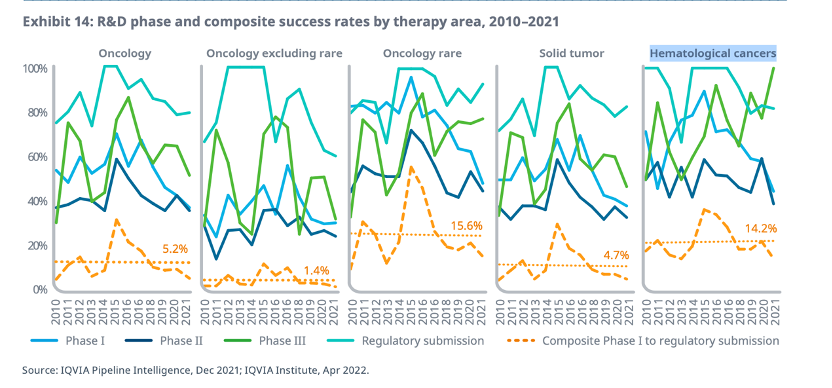
但值得注意的是,在2021年,抗肿瘤药物研发的综合成功率降至了5.2%,2015年以来这一数字一直呈下降趋势,抗肿瘤药物研发是所有治疗领域中综合成功率最低的领域之一。
综合成功率主要基于从临床研发到获得监管机构批准上市的成功几率,仅有一个适应证成功,多个适应证失败也计算在内。
但是,不同肿瘤的成功率存在显著差异,罕见肿瘤的研发综合成功率几乎是非罕见癌症的十倍。IQVIA统计,2021年从临床I期到申报上市,罕见肿瘤的平均综合成功率为15.6%,而非罕见肿瘤仅有1.4%。血液肿瘤的综合成功率也显著高于实体瘤。
2010-2021年各肿瘤治疗领域在I、II、III研发阶段的复合成功率
IQVIA观察到,抗肿瘤新药的研发也日益聚焦创新机制和创新靶点。在2012年,只有9种针对血液肿瘤的新兴生物疗法,而到 2021 年,这个数字已经增长到200种,占血液肿瘤研发管线的28%。同时,过去十年间大幅增长的免疫肿瘤药物在近年来开始逐渐减少。2018年开始,用于实体瘤的免疫疗法管线开始增长缓慢,到了2020年,数量开始下滑。IQVIA推测,这或许意味着研发正在转向新的机制和靶点。
2012-2021年细胞与基因疗法在血液肿瘤和实体肿瘤领域的研发数量
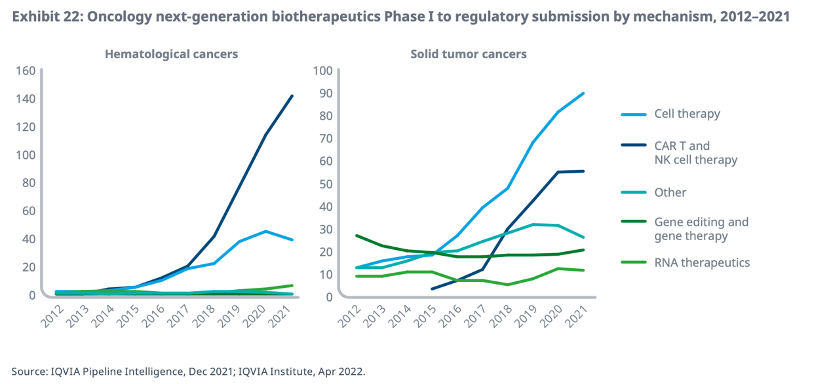
但另一方面,细胞疗法正在脱颖而出。2017年以来,全球CAR-T、CAR-NK等细胞疗法治疗血液肿瘤的研发数量几乎直线上升;治疗实体瘤细胞疗法的研发管线自2015年以来也在快速增长。
但在基因疗法方面,由于大量不良反应事件,甚至是临床试验患者死亡事件频发,针对血液瘤和实体瘤的基因疗法管线仍在缓慢增长,IQVIA认为,突破基因疗法的安全性问题,将为其带来更远大的开发前景。
2011-2021年肿瘤管线数量在各类型制药公司的分布
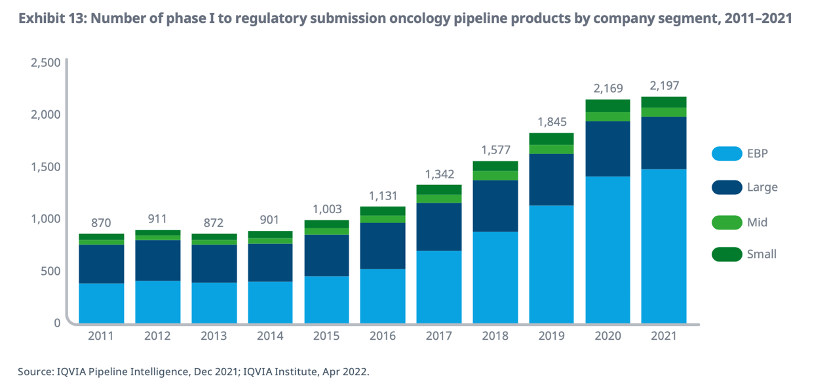
值得关注的是,年销售额低于5亿美元、研发支出低于2亿美元的新兴技术公司,其在研抗肿瘤新药管线数量占据了全球的近68%,而哪些拥有年销售额超过10亿美元的重磅炸弹产品的大型制药公司,其贡献比例仅为23%,这一数字在2016年还是39%。
此外,IQVIA统计,越来越多的肿瘤研究和开发发生在中国,目前总部设在中国的制药公司贡献了全球的抗肿瘤新药研发管线的19%。
本文编辑自IQVIA报告《Global Oncology Trends 2022:OUTLOOK TO 2026》
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..