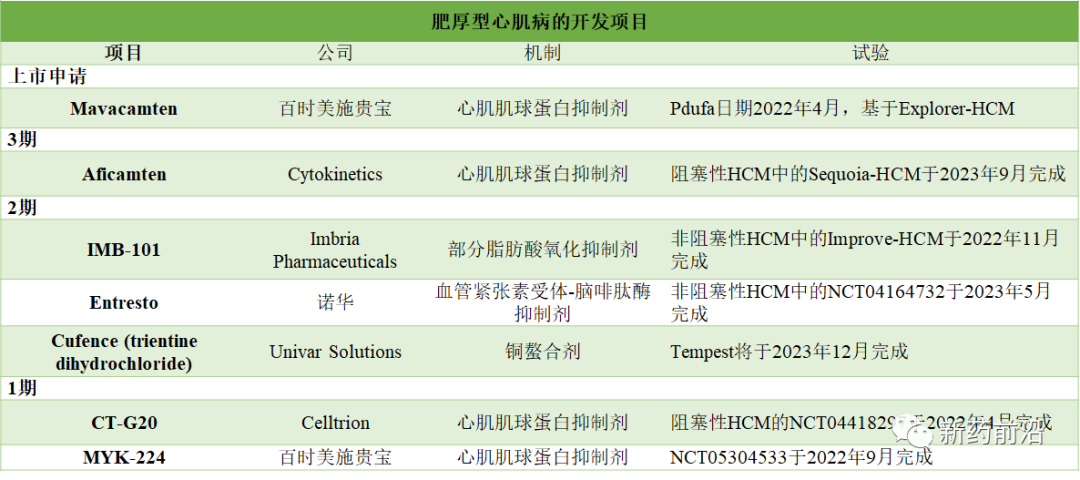
4月28日,FDA将会对百时美施贵宝的心肌病新药Mavacamten进行裁决。
Mavacamten是新型(first-in-class)口服心脏肌球蛋白的变构调节剂。2020年10月,百时美施贵宝通过131亿美元收购Myocardia公司获得该药,以减少公司对癌症药物的依赖,加强其心脏病治疗的地位。
Mavacamten通过抑制导致过度收缩、左心室肥大和顺应性降低的过度肌球蛋白-肌动蛋白交叉桥形成来降低心肌收缩力。在临床和临床前研究中,Mavacamten一直在降低心壁压力的生物标志物,减少过度的心脏收缩,并增加舒张顺应性。
2021年3月19日,FDA已接受Mavacamten的新药申请(NDA),用于有症状的阻塞性肥厚型心肌病(oHCM)的患者。FDA将处方药用户费用法案(PDUFA)的目标日期指定为2022年1月28日。
该NDA提交是基于关键的3期EXPLORER-HCM试验的结果,该试验评估了Mavacamten在有症状的oHCM患者中与安慰剂的对比。试验结果表明,Mavacamten表现出强大的治疗效果,在症状、功能状态和生活质量方面具有临床意义的改善,并可缓解左心室流出道梗阻的能力。在EXPLORER-HCM研究中,所有主要和次要终点均具有统计学意义。
不过,FDA在去年11月将PDUFA期限推迟了3个月至今年4月28日,原因是该机构需要更多时间来制定一项安全监测计划(风险评估和缓解策略)。
值得一提的是,2020年8月,联拓生物在创立当天宣布与MyoKardia达成战略合作,引进Mavacamten在中国及其他亚洲地区开发和商业化权利,为此支付4000万美元首付款和1.475亿美元监管和销售里程碑付款。
今年2月7日,国家药品监督管理局药品审评中心授予Mavacamten突破性治疗药物认定,用于治疗有症状的oHCM成人患者,以改善运动能力、纽约心脏病协会(NYHA)心功能分级和症状。
联拓生物计划进行一项代号为EXPLORER-CN的3期注册研究和一项药代动力学(PK)研究。如果以上临床研究结果与全球临床数据一致,联拓生物将结合中国数据和全球数据,递交上市申请。
百时美施贵宝计划今年开始一项非阻塞性HCM的3期研究,该项目用于射血分数保留心力衰竭的研究也进入到2期。
Mavacamten也不乏竞争者。
去年,Cytokinetics公司公布了其HCM新药Aficamten(CK-274)令人鼓舞的2期数据。该药物在阻塞性HCM方面获得了FDA的突破性指定,正在进入名为SEQUOIA-HCM的3期临床试验阶段。 而该项目用于非阻塞性疾病的研究正处于2期。
而在国内,2020年7月,箕星与Cytokinetics签订许可合作协议,箕星获得了Aficamten在大中华地区开发和商业化的独家许可。
2021年12月,箕星宣布顺利完成Aficamten用于治疗肥厚型心肌病的中国1期临床试验。
今年2月16日,国家药品监督管理局药品审评中心授予Aficamten治疗症状性梗阻性肥厚型心肌病(oHCM)的突破性治疗药物认定。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..