在过去的半个世纪里,在管理与体重超重密切相关的疾病方面取得了巨大进展,例如高血压、成人糖尿病和胆固醇升高。然而,肥胖本身的治疗已被证明在很大程度上对治疗药物具有抵抗力,抗肥胖药物通常存在疗效不足且有安全性问题而遭受质疑。
近年来的研究进展,包括对分子肠-脑连接等理解的深入,正在激发对新一代抗肥胖药物开发的热潮,而且新型抗肥胖药物似乎能够安全地实现可观和持续的体重减轻。
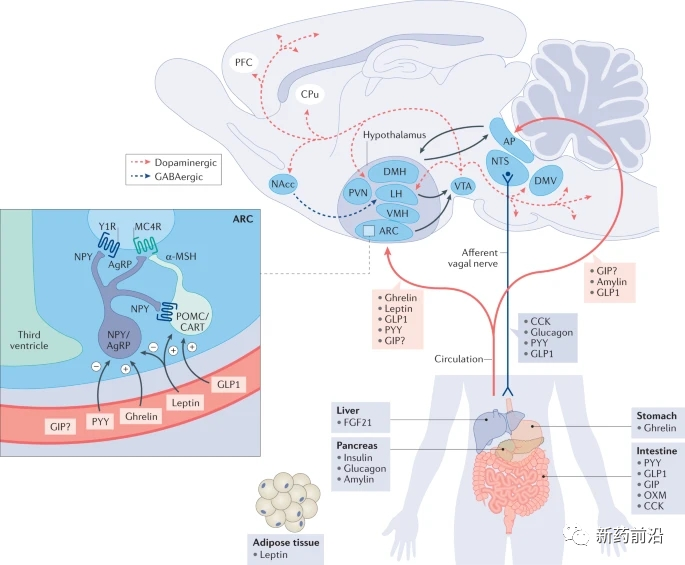
图 1:食物摄入的肠脑调节
01
肠促胰素疗法
GLP1药物
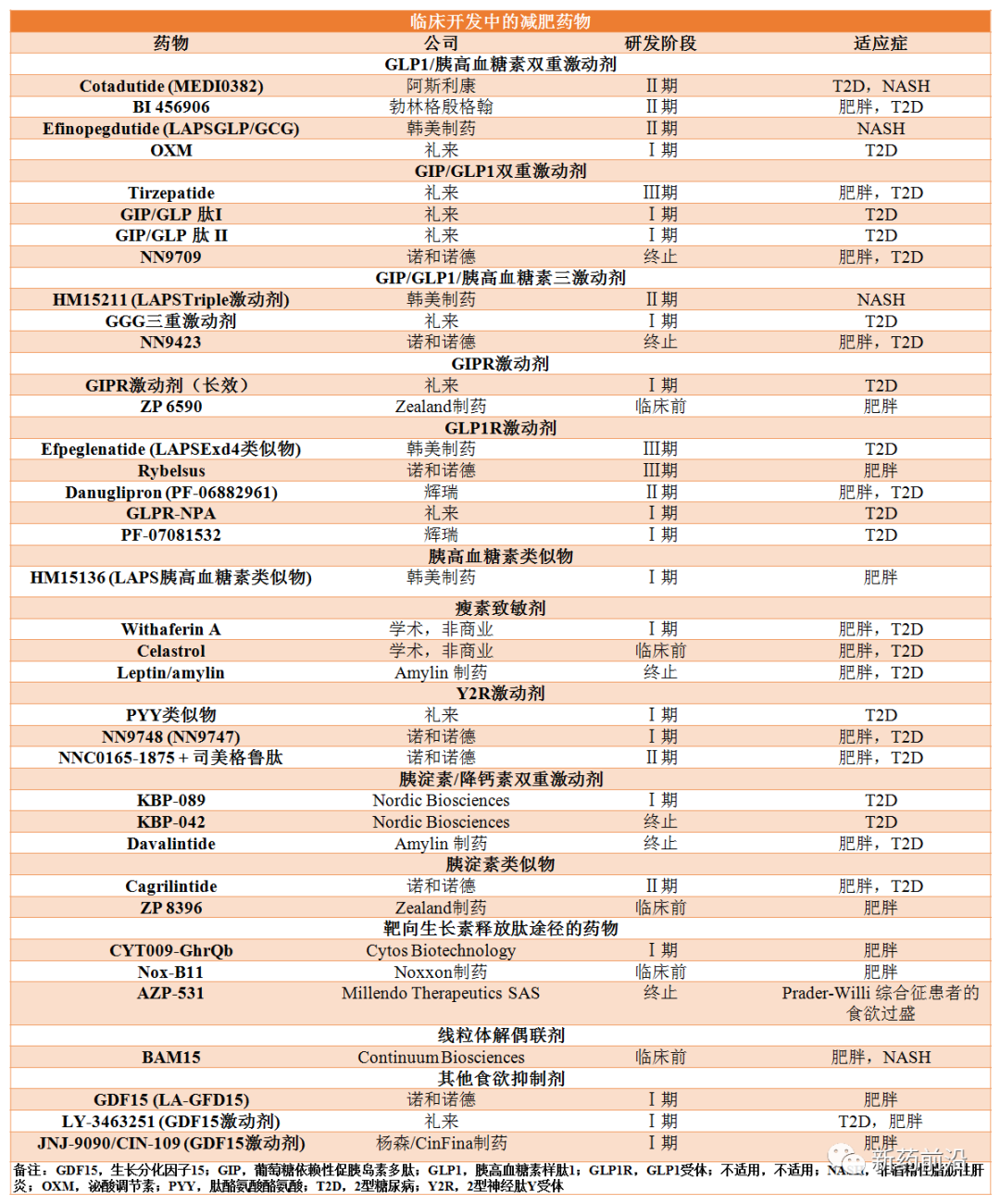
过去几十年肠促胰岛素生物学的进步促使多款人胰高血糖素样肽1受体(GLP1R)激动剂获批上市。
在使用GLP1R激动剂的初始临床研究中,体重减轻的幅度不大,并且与之前用其他肠道激素观察到的结果基本一致。后来通过延长该类药物的作用,改善其药代动力学特性,以及减少胃肠道不良反应频率的剂量调整,实现了更持久和更强烈的治疗,从而巩固了GLP1R激动剂的代谢和减肥效果。
2014年底,诺和诺德的利拉鲁肽3mg成为第一个被FDA批准用于治疗肥胖症的GLP1R激动剂,大约是治疗2型糖尿病所用最高剂量的两倍。治疗1年后,接受利拉鲁肽治疗受试者的体重平均下降8%,而接受安慰剂治疗的受试者体重平均下降2.6%,接受利拉鲁肽治疗大约三分之二患者体重下降超过5%,三分之一下降超过10%。相比之下,在对照组中取得相似结果的仅分别为27%和11%。
诺和诺德的司美格鲁肽2.4mg剂量远高于治疗2型糖尿病剂量,于2021年6月获得FDA批准,用于肥胖或超重成人的慢性体重管理。在最近对无糖尿病的超重患者进行的Ⅲ期临床试验中,每周一次2.4mg司美格鲁肽治疗68周后体重下降了14.9%,而安慰剂对照组的体重下降2.4%。在糖尿病和肥胖患者中,司美格鲁肽使体重降低了9.6%,而安慰剂对照为仅下降3.4%。
此外,诺和诺德还在开发口服司美格鲁肽,是否可达到预期体重减轻效果仍有待证明。今年4月,诺和诺德启动关键性Ⅲa期临床试验,在约1000名肥胖或超重,并伴有合并症的患者中检验口服司美格鲁肽的疗效和安全性。
其他几种肽和小分子GLP1R激动剂目前正处于临床开发阶段,包括设计用于口服给药的制剂。礼来的口服GLP1R激动剂(GLPR-NPA)目前正在进行II期临床试验中。
GIP药物
使用促胰岛素多肽(GIP)受体(GIPR)激动剂治疗肥胖症和2型糖尿病广受质疑,因为GIP的促胰岛素作用在2型糖尿病患者中很弱。此外,临床前证据表明GIPR拮抗剂可以改善全身能量和葡萄糖代谢,其机制可能是通过改善中枢瘦素敏感性。
然而,在一系列临床前研究中,长效GIPR激动剂已被证明可以减轻体重并改善葡萄糖处理,并且长效GIPR激动剂正处于治疗2型糖尿病的Ⅰ期临床试验中。
多重激动剂
于选择性GLP1R和GIPR单激动剂相比,同时靶向GLP1、GIP和/或胰高血糖素受体的多重激动剂也在取得研究的新突破,并且有多种候选药物已进入临床开发阶段。
目前,已经报道了两种单分子、长效GIPR/GLP1R激动剂的Ⅱ期结果。
第一种是诺和诺德NN9709(以前称为MAR709和RG7697),每天一次皮下注射。在一项治疗2型糖尿病为期12周的Ⅱ期研究中,与安慰剂相比,NN9709降低了血糖、体重和总胆固醇。然而,相对于利拉鲁肽,NN9709对体重的改善没有统计学差异。鉴于司美格鲁肽2.4mg在Ⅲ期临床试验中的疗效,NN9709的开发于2020年终止。
与GLP1R相比,礼来的tirzepatide(LY3298176)设计用于每周一次皮下注射。在2型糖尿病患者的Ⅱ期试验中,与特定的每周一次GLP1R激动剂相比,tirzepatide治疗26周时在HbA1c和降低体重方面显示出显著优越的结果。在最高剂量下,血糖控制异常强,近三分之一的患者HbA1c<5.7%,患者体重减轻超过10%。在最近对体重超重的2型糖尿病患者进行的Ⅲ期试验中,与1mg司美格鲁肽相比,tirzepatide在所有测试剂量下都显示出优异的降低HbA1c和体重的能力。
GLP1R激动剂与胰高血糖素(GcgR)激动剂的联合治疗旨在采用不止一种机制来减轻体重(分别是食欲抑制、产热和脂肪分解),同时将高血糖症的风险降至最低。已经报告了两种GLP1R/GcgR共激动剂cotadutide(以前称为MEDI0382)和SAR425899的临床结果。
在一项对伴有2型糖尿病的超重和肥胖患者进行的为期54周的IIb期研究中,与安慰剂相比,cotadutide降低了体重和肝脏脂肪含量,并改善了葡萄糖耐量,平均体重减轻约5%(15.5%的患者体重减轻超过10%),而利拉鲁肽1.8mg组患者为5.8%。
SAR425899已在健康志愿者和2型糖尿病患者中完成I期试验。据报道,治疗4周后体重减轻了约7%,葡萄糖耐量有所改善。
其他具有更高相对胰高血糖素活性或更长作用持续时间的单分子GLP1R/GcgR共激动剂是否证明对长期使用更有效且足够安全,仍有待确定。
GLP1与GIP或胰高血糖素多重激动剂所表现出的效果增强性能已经使制药公司针对胰高血糖素样肽进行的进一步开发,并已进入临床研究。
NN9423是一种三重激动剂,已进入临床研究,但结果尚未报告就遭遇终止。其他候选药物包括一系列脂肪酰化单分子GLP1R/GIPR/GcgR三重激动剂和Fc融合。这些候选药物中的后者(HM15211)目前正处于治疗非酒精性脂肪性肝炎的早期临床试验中。
LY3437943(GGG)是一种GIP/GcG/GLP1三重激动剂,适合每周给药一次。在I期临床试验中,对2型糖尿病患者进行12周的治疗显示,与tirzepatide相比,体重减轻更显著,但血糖疗效相同。
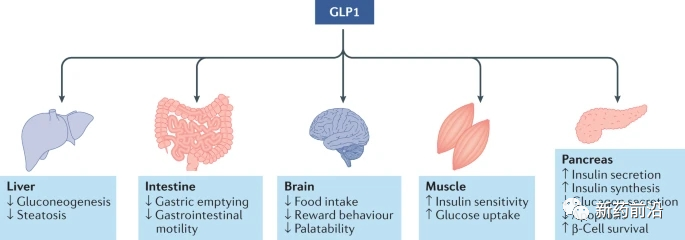
图 2:GLP1R 激动对体重和葡萄糖代谢的调节
02
瘦素增敏剂
1994年瘦素的发现加深了研究者对外周激素如何向大脑发出信号以调节能量平衡的理解。瘦素的丢失会导致严重的代谢紊乱,包括极度的食欲亢进、脂肪代谢障碍和下丘脑闭经。
瘦素类似物Metreleptin(Amylin制药,已被阿斯利康收购)于2014年获得FDA批准,并于2018年获得欧洲药品管理局(EMA)的批准,用于治疗脂肪营养不良,可以弥补瘦素的缺乏,抑制脂肪的代谢障碍。
然而,尽管补充瘦素对先天性瘦素缺乏症患者有效,但在常见、多基因、肥胖的情况下,这种激素几乎没有独立降低体重的能力。但瘦素与普兰林肽(Amylin制药)的组合可在超重个体中诱导更强的体重减轻效果。在与毒蜥外泌肽4、FGF21或GLP1/胰高血糖素联合使用后,瘦素反应性的改善也已在临床前得到证实。此外,植物来源的小分子如celastrol和withaferin A已被证明可以通过改善瘦素敏感性来减轻体重。
03
胰淀素
胰淀素(IAPP)是一种与胰岛素共同分泌的肽,可通过饱腹感通路的中枢控制减少食物摄入。
人胰淀素受体亚型是降钙素受体与受体活性修饰蛋白的复合物。最近,双作用胰淀素和降钙素受体激动剂(DACRA)已被开发为潜在的抗肥胖药物。几种DACRA(例如,davalintide(AC2307)、KBP-088、KBP-089、KBP-042)已被证明可在肥胖动物模型中诱导体重减轻。此外,适合每周一次治疗的长效胰岛淀粉样多肽类似物Cagrilintide已成功完成Ib期试验,并且在后续研究中与司美格鲁肽联合使用,可能会增强长期疗效。
04
胃饥饿素
胃饥饿素(ghrelin)作为从胃底的x/a样细胞(人类的P/D1细胞)分泌的肽激素,作用于下丘脑喂养中心以刺激食物摄入。
降低酰基-胃饥饿素的方法包括一种治疗性肽疫苗,可以改善啮齿动物的体重增加,不影响食物摄入。Cyto Biotechnology开发了一种类似的作用疫苗CYT009-GhrQb已进入早期临床试验(I/II期),其中显示对体重或食物摄入量没有影响。
05
靶向线粒体解偶联剂
线粒体解偶联的增强可以对健康产生有益的影响。线粒体解偶联剂,例如2,4-二硝基苯酚(DNP),会增加线粒体效率低下,从而降低ATP的代谢和生产效率。
线粒体解偶联剂在高浓度下具有细胞毒性,这是由于ATP浓度下降以及血浆和溶酶体膜去极化和透化作用所致。然而,这种效应是浓度依赖性的,在无毒的剂量下,线粒体解偶联可以保护细胞免于死亡。因此,适合人类使用的线粒体特异性和更安全的解偶联剂的开发可能会导致治疗这些疾病的强大和差异化方法。最近使用DNP控释口服制剂(CRMP(控释线粒体质子细胞))的研究是实现增强治疗指数的一项重要尝试。
BAM15是一种新型的线粒体特异性质子细胞解偶联剂,增加能量消耗显示出与DNP相似的效力。BAM15是一种口服药物,可以增加营养氧化,减少体脂肪量,而不会改变食物摄入量、瘦体重、体温或血液学毒性标志物。然而,现在BAM15或其他相关方法是否会为治疗肥胖相关的合并症或体重过重本身提供大大增强的治疗安全性还为时过早。
06
GDF15
巨噬细胞抑制性细胞因子1(MIC1;也称为GDF15)作为肥胖治疗的靶点而受到关注。在生理上,GDF15在多种组织中以低浓度表达,但随着组织损伤、癌症、代谢疾病、心血管疾病和炎症的反应或与之相关而增加。
最近,GDF15被证明通过通过食欲抑制,可在生理上调节能量稳态和体重。不过,只有在人体研究中才能确定GDF15类似物是否对减肥管理有效和安全。诺和诺德的GDF15(LA-GFD15)、礼来的LY-3463251等正在进行I期试验。
07
肽酪氨酸酪氨酸
肽酪氨酸酪氨酸(PYY)是NPY家族的成员,与GLP1一起从肠道L细胞中以PYY1-36的形式共同分泌。释放后,PYY1-36被DPP-IV迅速切割为其主要活性形式PYY3-36。研究显示,PYY3-36可减少啮齿类动物和人类的食物摄入量和体重。
几种长效PYY3-36类似物(NN9748和NNC0165-1875)已经完成了治疗肥胖症的I期试验,NNC0165-1875与司美鲁肽联合应用正在II期研究中进行评估。此外,礼来也宣布了一项使用PYY类似物治疗2型糖尿病的I期试验。
参考文献:Müller, T.D., Blüher, M., Tschöp, M.H. et al. Anti-obesity drug discovery: advances and challenges. Nat Rev Drug Discov (2021). https://doi.org/10.1038/s41573-021-00337-8
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..