多款口服选择性雌激素受体降解剂(SERD)关键临床试验数据正在陆续公布,有喜有忧!该领域晚期项目的空间可能很快会变得更加拥挤,在SERD冲刺的晚期关键阶段,谁会顺利撞线?又有谁会重蹈别人失败的覆辙或汲取有益于其项目开发的经验?
01
试验设计决定成败?
3月14日,赛诺菲发布公告称,经独立评审委员会(IRC)评估,其开发的口服SERD新药Amcenestrant在2期AMEERA-3临床试验没有达到改善无进展生存期(PFS)的主要终点。
AMERA-3是一项开放标签、2期随机试验,在激素治疗期间或之后进展的局部晚期或转移性雌激素受体阳性(ER+)/人表皮生长因子受体2阴性(HER2-)乳腺癌患者中,评估Amcenestrant作为单一疗法与医生选择的内分泌疗法的疗效和安全性。由独立评审委员会评估的无进展生存期为研究主要终点。关键的次要疗效终点是总生存期,其他次要终点是客观缓解率、疾病控制率、临床受益率和缓解持续时间。
Amcenestrant在ER+/HER2-乳腺癌中未能通过此前经3次延迟的Ameera-3试验,行业分析者不禁发出这样的质疑:那么可以将多少责任归咎于其糟糕的研究设计?
随着竞争对手口服SERD的关键临床试验方法和结果的公布,这个问题将变得越来越重要。
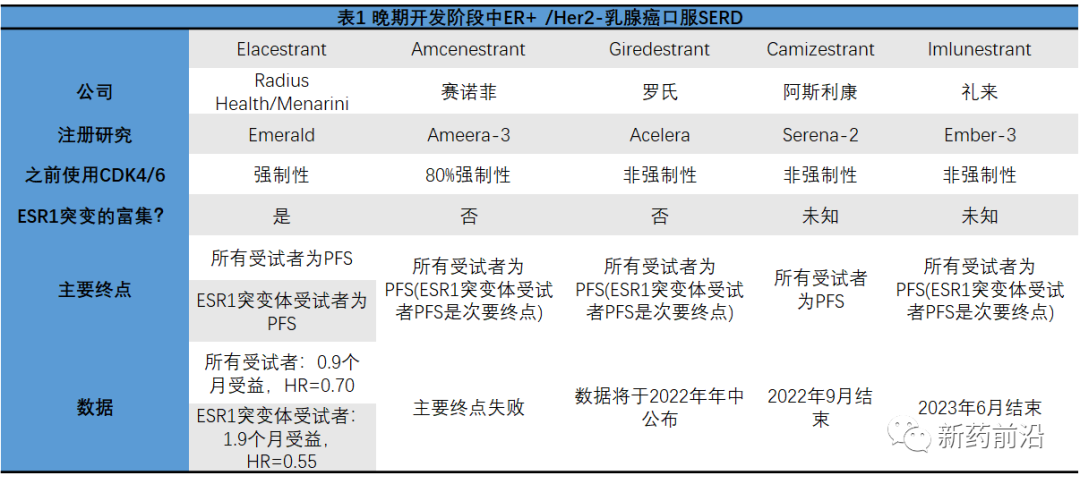
Ameera-3,以及所有其他关于口服SERD在ER+/HER2-乳腺癌中的关键研究,总是会面临之前使用细胞周期蛋白依赖性激酶(CDK)4/6抑制剂的问题。CDK4/6抑制剂已成为该患者群相对较新的治疗标准,并且正在改变目前的治疗格局。然而,问题是目前还不清楚最好的后续疗法是什么。
Ameera-3的设计要求至少80%的患者是必须使用CDK4/6抑制剂治疗失败者。因此,一个风险是患者将在获得由此产生的强大益处,并且随后的Amcenestrant和氟维司群/芳香酶抑制剂对照组之间无进展生存期的数值差异将太小而无法达到统计学意义。
到目前为止,赛诺菲尚未发布有关基础数据的详细信息。Ameera-3的唯一主要终点涉及所有受试者的无进展生存期。
但一个可能更大的问题是赛诺菲的试验没有单列的携带雌激素受体1(ESR1)突变患者。ESR1被认为是对芳香化酶抑制剂(治疗的基石)的常见耐药机制,但可以从新一代SERD治疗获益。
这里最重要的比较者是Radius/Menarini的竞争项目Elacestrant。在赛诺菲Amcenestrant的长期延误之后,该项目于去年12月以积极的关键数据超越了Amcenestrant。
Elacestrant的Emerald试验在所有受试者和ESR1突变携带者中都获得了阳性结果,但完整的数据毫无疑问地表明,正是ESR1突变组(Elacestrant和标准疗法无进展生存期中位数分别延长为:3.78个月和1.87个月)推动了所有受试者(Elacestrant和标准疗法无进展生存期中位数分别延长为:2.79个月和1.91个月)无进展生存期的受益,后者相当于不到一个月的无进展生存期获益。
Emerald和Ameera-3之间的关键区别在于前者确实丰富了具有ESR1突变的患者,从而最大限度地提高了成功的机会。
赛诺菲表示,Amcenestrant的两项3期研究继续进行,没有任何变化,包括Ameera-5研究,与哌柏西利联合作为一线治疗,以及Ameera-6研究,在改良的辅助环境中(激素受体阳性HR+早期乳腺癌患者)的应用。
不过,由于这两项研究将分别在2024年和2026年才会公布结果,因此即使取得了积极试验结果,Amcenestrant也将失去曾经看起来对Elacestrant来说重要的先发优势。
02
追赶者避免重蹈覆辙
现在行业的注意力落在了其他竞争对手身上,如罗氏、阿斯利康和礼来。这些竞争对手都可能超越赛诺菲获得积极的关键数据。
预计罗氏的Giredestrant和阿斯利康的Camizestrant进度较快,将于2022年晚些时候提供数据。
罗氏的Giredestrant,其二线/三线Acelera试验可能在未来三个月内公布数据。然而,与阿斯利康Camizestrant的Serena-2试验和礼来Imlunestrant的Ember-3试验研究一样,Giredestrant并不要求先前使用CDK4/6抑制剂,并将所有受试者的主要终点设计为无进展生存期。
对于罗氏、阿斯利康和礼来三家公司来说,修改研究方案可能已经为时已晚,除非这些公司在最后一刻决定修改其研究设计的主要终点。
而对于其他研究进度稍慢的竞争者来说,这无疑是一个汲取经验,快速赶超的绝佳机会。
Arvinas和Olema是两家分别有口服SERD开发项目ARV-471和OP-1250的小型公司,都还没有开始关键试验的开发。
在国内,D-0502是益方生物的自主研发口服SERD/雌激素受体拮抗剂,目前正在中国和美国同步开展国际多中心临床试验。益方生物在国内刚刚启动了一项D-0502治疗局部晚期或转移性乳腺癌的3期临床试验。从CDE中国药物临床试验登记与信息公示平台上公布的临床试验方案(登记号:CTR20220511)来看,同样是所有受试者的主要终点设计为无进展生存期。
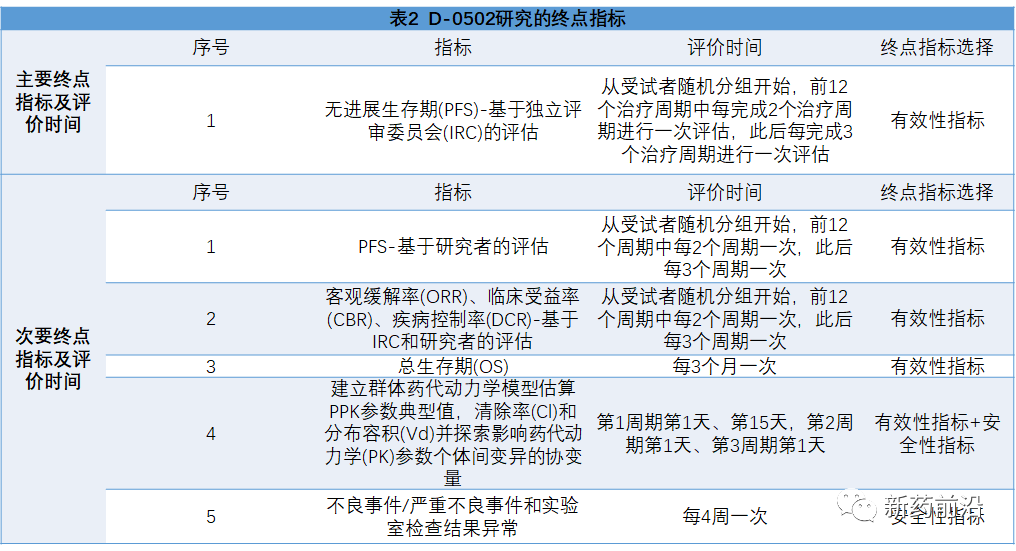
也许Ameera-3研究的数据会给他们在研究设计方面提供重要参考意义。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..