转甲状腺素蛋白淀粉样变性(ATTR)是一种罕见、进行性疾病,其特征是由错误折叠的转甲状腺素蛋白组成的淀粉样沉积物在器官和组织中异常堆积。如今,这种罕见疾病随着竞争者的进入,正在催生一些重磅项目。
2家公司新进入
去年12月7日,阿斯利康已与Ionis制药公司就后者研发中的反义寡核苷酸(ASO)药物Eplontersen(IONIS-TTR-LRX)达成了一项新的全球开发和商业化协议。根据协议条款,在Eplontersen获得监管机构批准后,阿斯利康将向Ionis支付2亿美元的预付款和最高达4.85亿美元的额外有条件付款。此外,根据5亿至60亿美元的上市销售门槛,阿斯利康还将支付最高达29亿美元的销售相关里程碑付款,以及视地区而定的两位数到20%不等的特许权使用费。
Eplontersen是一种配体结合的反义寡核苷酸研究性药物,目前用于治疗淀粉样蛋白转甲状腺素蛋白心肌病(ATTR-CM)和淀粉样蛋白转甲状腺素蛋白多发性神经病(ATTR-PN)处于Ⅲ期临床试验中。该药通过减少转甲状腺素蛋白(TTR)的产生,以治疗遗传性和非遗传性形式的转甲状腺素蛋白淀粉样变性(ATTR)。遗传性ATTR-PN预计将成为两家公司寻求Eplontersen监管批准的第一个适应症,并有可能在2022年底之前向美国食品药品管理局(FDA)提交新药上市申请。
然而,阿斯利康并非进入ATTR领域的唯一竞争者。
去年7月12日,诺和诺德和Prothena达成最终收购协议。根据该协议,诺和诺德收购了Prothena的全资子公司,并获得Prothena包括临床阶段抗体PRX004在内的ATTR淀粉样变性产品管线的知识产权和相关权利的全球权利。Prothena有资格获得总计最高达12亿美元的开发和销售里程碑付款,其中包括1亿美元的前期和近期临床里程碑付款。
PRX004是一种研究性人源化单克隆抗体(抗淀粉样蛋白免疫疗法),通过消除与遗传性和野生型ATTR淀粉样变性(hATTR和wtATTR)疾病病理相关的淀粉样蛋白,而不影响蛋白质的天然、正常四聚体形式。Prothena已在遗传性ATTR患者中完成了PRX004的Ⅰ期临床试验,发现PRX004安全且耐受性良好。诺和诺德计划在2022年PRX004进行Ⅱ期临床试验。
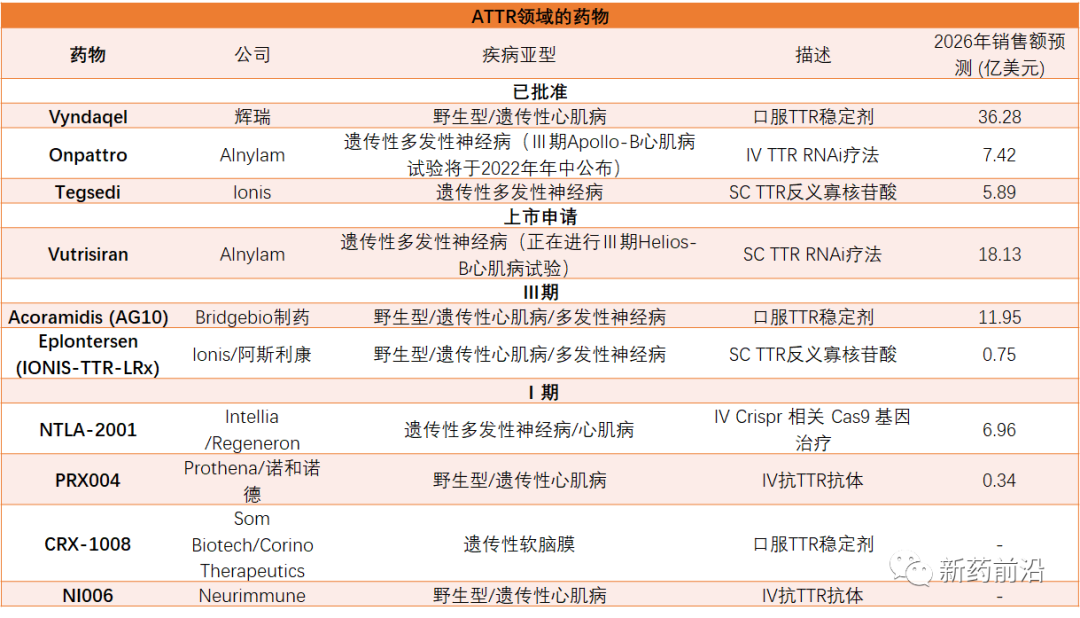
市场竞争日益激烈
Eplontersen如果最终获得批准,将会与Alnylam的RNA干扰疗法Onpattro(patisiran)和辉瑞目前快速增长的Vyndamax(tafamidis)产生直接竞争。
2018年8月Alnylam的Onpattro获得FDA批准,成为首个上市的RNAi治疗药物。Onpattro用于治疗hATTR引起的多发性周围神经疾病,该疾病是一种严重而致命的罕见神经性疾病。Onpattro能发挥RNAi对基因的“沉默”效果,通过抑制特定mRNA的表达,有效阻止变异甲状腺素运载蛋白的生成,清除组织里的淀粉样蛋白沉积,恢复组织功能。
不过,ATTR领域市场的最大竞争者是辉瑞的Vyndamax。
FDA于2019年批准该公司的Vyndaqel(tafamidis meglumine)和Vyndamax(tafamidis)上市,用于治疗因为野生型或遗传性转甲状腺素蛋白介导的淀粉样变性引起的心肌病(ATTR-CM)。Vyndaqel和Vyndamax是新型转甲状腺素蛋白稳定剂tafamidis的两种口服配方,是FDA批准的第一款治疗AATR-CM的疗法。
全球估计有300000至500000名ATTR患者。尽管该疾病被定性为一种罕见疾病,但可能并不像人们想象的那么罕见。例如,辉瑞曾表示ATTR可能是一种未被充分诊断的更普遍的疾病。因此,推动疾病意识和诊断一直是辉瑞推出Vyndamax的关键策略。
尽管存在新冠大流行障碍,辉瑞的Vyndaqel和Vyndamax仍达到了重磅炸弹级的门槛。2021年前九个月,Vyndamax和Vyndaqel为辉瑞带来了14.5亿美元的全球销售额,同比增长66%。
Ionis制药公司开发的Tegsedi(inotersen)虽然于2018年获得FDA批准用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR)患者的多发性神经病(polyneuropathy),该药是世界上首个且唯一一个适用于hATTR患者的反义寡核苷酸药物。由于其标签限制和安全问题,该药物的市场表现令人失望。Ionis最近将Tegsedi的北美营销业务转移给了Sobi。
Alnylam制药公司的Vutrisiran是一款在研皮下给药的RNAi疗法,该药能够靶向和沉默特定mRNA,从而阻断野生型和突变体转甲状腺素蛋白的产生,延缓疾病进展。该药用于治疗遗传性转甲状腺素蛋白淀粉样变性多发性神经病(hATTR-PN)成人患者,目前已在欧美提交新药上市申请。近日,Alnylam也公布了Vutrisiran的Ⅲ期HELIOS-A研究的18个月积极结果。之前,该研究在9个月时间点达到了主要终点和全部次要终点。
此外,BridgeBio口服活性的、选择性TTR稳定剂Acoramidis,也在Ⅲ期阶段测试中。
据华尔街分析人士估计,如果能够顺利获批上市,到2030年,Ionis的Eplontersen销售额可以达到13亿美元。而Alnylam的Vutrisiran销售额将达到36亿美元。
而据医药市场调研机构Evaluate Pharma预测,到2026年,辉瑞的Vyndaqel将会取得36.28亿美元的收入,处于ATTR市场领先地位;Alnylam的Vutrisiran和Bridgebio制药的Acoramidis都会达到重磅炸弹级别(10亿美元以上)。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..