据Endpoints News报道,FDA正式批准传奇生物与Janssen Biotech BCMA CAR-T。“我们准备好了,”传奇首席执行官周一告诉 Endpoints News。“实际上,我们已经聘请了一支实干团队,包括销售人员、护士教育者、MSL、医学联络员。因此,我们确实有一支准备就绪的销售和营销团队。”
传奇生物的CAR-T疗法—西达基奥仑赛(也可称为“cilta-cel”)旨在增加其靶向癌细胞的综合能力,用于成人复发/难治性多发性骨髓瘤(MM)的治疗,今日成为首款出海的细胞疗法,值得庆贺!尤其是信达PD—1“闯关”FDA事件之后,更是为国内药企实现全球化创新带来了动力。
据悉,2017年12月,杨森与传奇生物达成一项许可协议,传奇授予杨森在全球共同开发和推广cilta-cel权利,在大中华地区,杨森与南京传奇将以30/70的比例共同承担成本和分享收益。在全球的其他地区,这一比例为50/50。
西达基奥仑赛临床数据“漂亮”,获多项认定
西达基奥仑赛于2018年获得国家药品监督管理局的首个CAR-T临床试验申请(IND)批件,并于同年获得美国FDA的IND批准,随后获得FDA突破性疗法和孤儿药认定,于2019年获得欧洲药品管理局优先药物认定(PRIME)资格及美国FDA授予的突破性疗法认定,2020年8月,又获中国首个“突破性疗法”资格认证。2020年12月,传奇生物向FDA滚动递交cilta-cel的生物制剂许可证申请 (BLA)。同月,杨森又向日本厚生劳动省提交了cilta-cel的新药申请(NDA)。
在去年6月举行的ASCO年会和欧洲血液学协会(EHA)在线虚拟大会上,传奇生物更新的CARTITUDE-1 1b/2期研究结果显示,18个月中位随访的总客观缓解率(ORR)为98%,其中80%的患者达到严格意义的完全缓解(sCR),较ASH 2020公布的数据增加13个百分点。
18个月无进展生存(PFS)率为66%,总生存率(OS)为81%。患者之前接受了中位数6线治疗(范围3–18);其中88%的患者三重耐药,42%的患者五重耐药。
这些数据优于已经获批上市的BCMA CAR-T疗法Abecma,在其实关键性的2期临床试验数据中,共计纳入了127名至少接受过3种疗法的复发/难治性多发性骨髓瘤患者。在接受治疗后可评估疗效的100名患者中,总缓解率(ORR)为72%,有28%的患者完全缓解(CR),治疗后起效的中位时间是30天,中位持续缓解时间为11个月。
而cilta-cel另外一项CARTITUDE-2 A队列的研究数据也同样称得上优秀,在5.8个月的中位随访中,总缓解率(ORR)为95%,75%的患者达到了sCR/CR,20%的患者达到了部分缓解或非常好的部分缓解。
值得一提的是,传奇生物西达基奥仑赛FDA递交上市的申请基础为全球多中心临床试验数据,涉及美国、日本、欧盟等地区的临床研究数据,并且传奇生物主要终点设置为ORR,与已获批的Abecma设置标准对应,再者,美国市场仅一款同类型产品上市,且西达基奥仑赛面临的竞争较小。
国内外上市的CRA—T细胞疗法及本土企业的布局情况
自2017年美国FDA先后批准上市诺华和Kite的CAR-T疗法之后,全球现已批准上市了6款CAR-T疗法产品。其适应症均为血液肿瘤,涉及淋巴细胞白血病和骨髓瘤等,并未涉及实体瘤,而靶点涉及CD19和BCMA。
诺华的Kymriah作为FDA批准的首款CAR-T细胞疗法,目前在30个国家获批一项或多项适应症,在全球拥有超过350个经认证的治疗中心。随着覆盖范围的扩大,Kymriah 2021年销售额达到5.87亿美元,同比增长24%。去年10月,Kymriah第3项适应症上市申请获美国FDA和欧盟EMA受理,用于既往接受二线治疗后复发或难治性(r/r)滤泡性淋巴瘤(FL)成年患者。而在滤泡性淋巴瘤领域,Kite Pharma的CAR—T细胞疗法已基于ZUMA-5研究91%的ORR,60%的CR于去年3月获FDA批准。
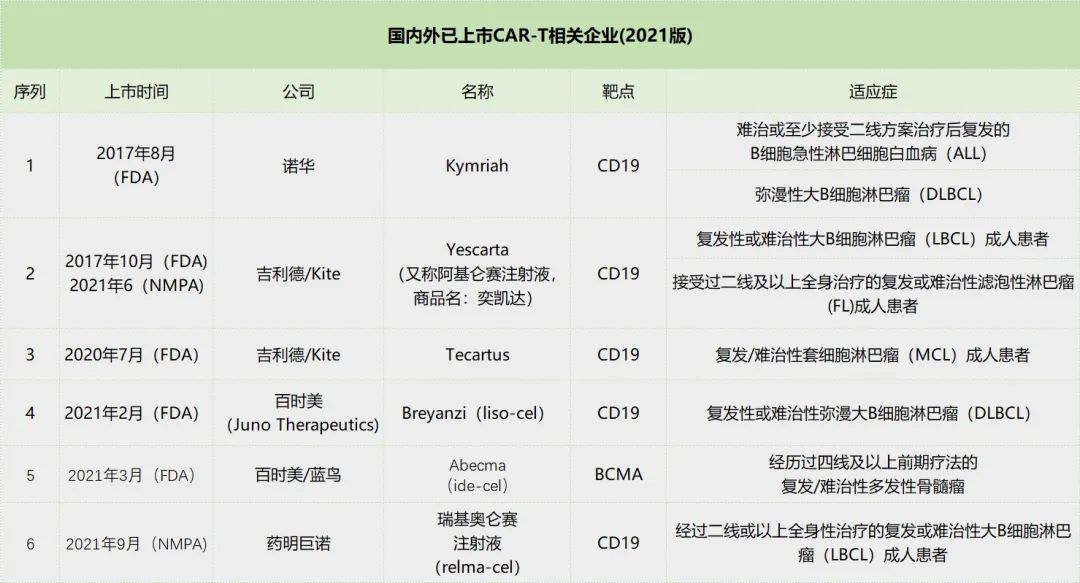
另一方面,国内已有两款CAR—T疗法上市。2021年6月22日,Yescarta(又称阿基仑赛注射液,商品名:奕凯达)正式获得批准,成为国内首款上市的CAR—T细胞疗法,其适应症为:用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者。
2021年9月,药明巨诺申报的1类新药,靶向CD19的CAR-T产品瑞基奥仑赛注射液(relma-cel,商品名:倍诺达)在国内获批上市,用于治疗经过二线或以上全身性治疗的复发或难治性大B细胞淋巴瘤(LBCL)成人患者。2022年2月27日,药明巨诺宣布其靶向 CD19 的自体嵌合抗原受体 T(CAR-T)细胞免疫治疗产品倍诺达®(瑞基奥仑赛注射液)用于治疗复发或难治性(r/r)滤泡淋巴瘤(FL)患者的新适应症上市许可申请已获 CDE 受理。这是药明巨诺针对倍诺达®递交的第二项上市许可申请。
国内企业在针对实体瘤的开发上领先于外企,如科济药业在全球Claudin18.2靶向CAR-T疗法开发上居领先地位。其研发的首个靶向Claudin18.2的CAR-T疗法(CT-041),在美国获批临床,目前正在开展针对晚期胃癌的临床研究。同时,该疗法在EMA、加拿大的临床研究也获得了进展。此外,南京凯地生物和南京传奇生物布局开发了靶向Claudin18.2的CAR-T疗法,目前均处于临床I期。以下是本土企业对CRT细胞疗法的开发情况(详见下图)。
传奇生物在CAR—T细胞疗法的开发上获得认可与阶段性胜利,这增强了国内其他企业对其研发的信心,同时对国产创新药的“出海”积累了可借鉴的经验,期待后续有更多本土创新药在实现全球化的进程中顺利闯关。
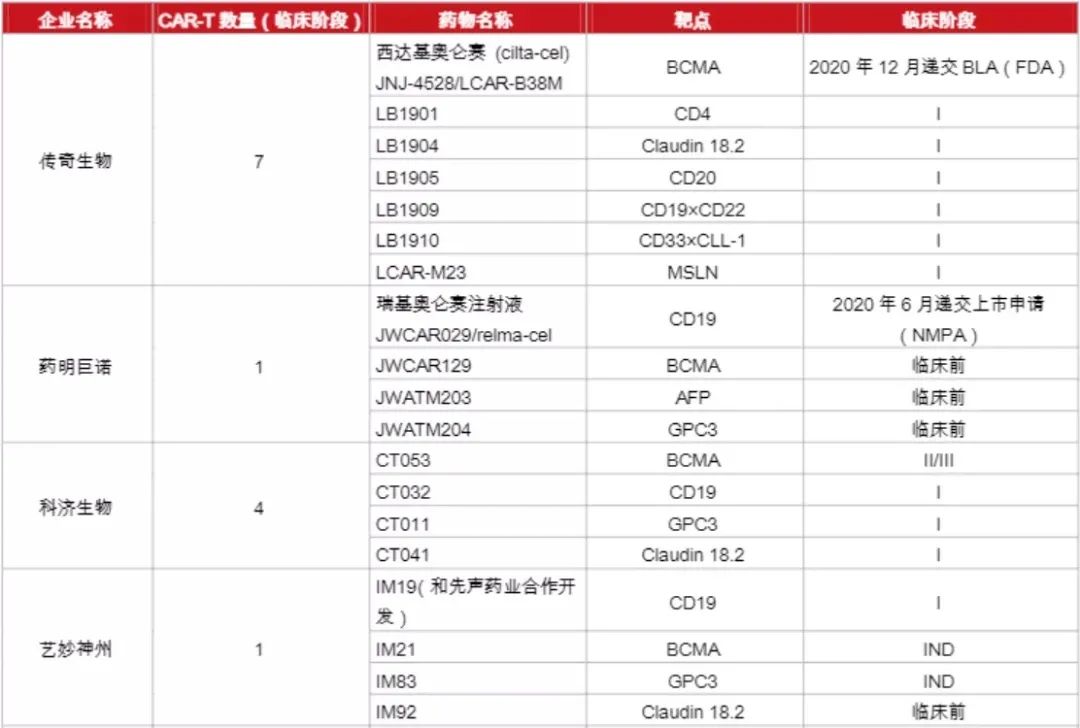
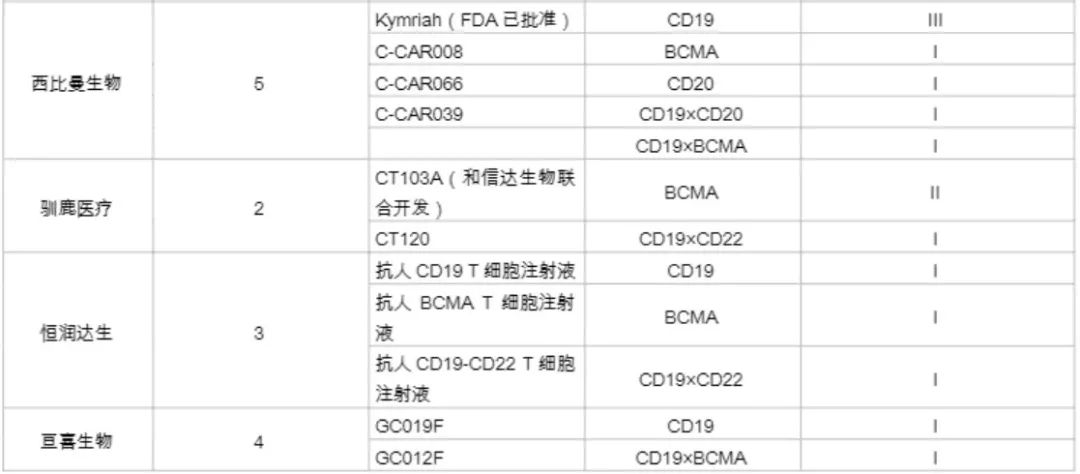
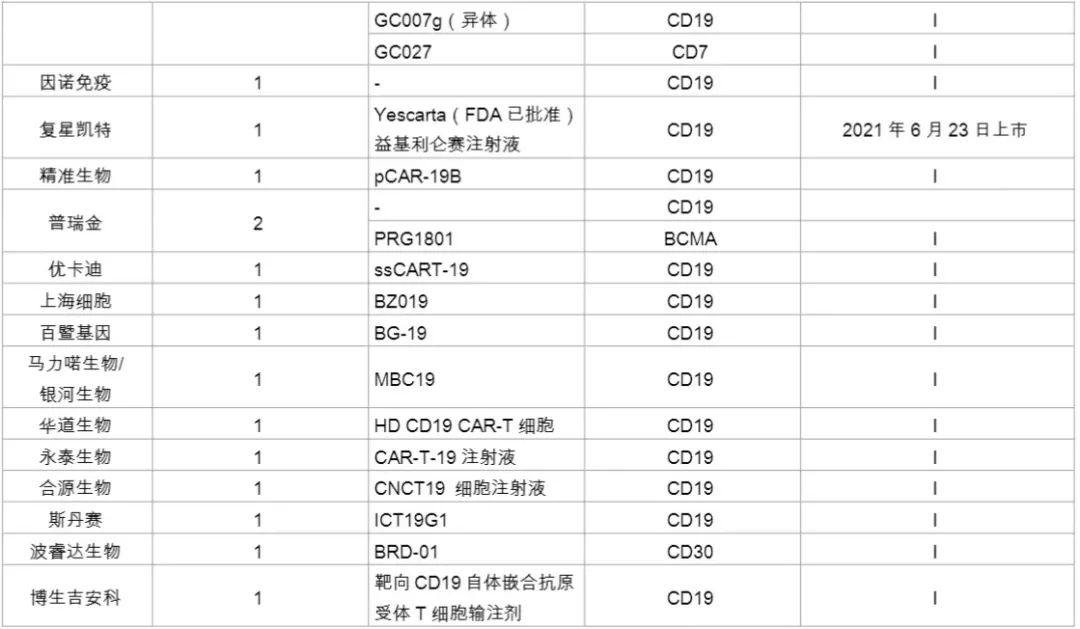
参考文章:CAR-T疗法大盘点 | 2021年国内代表企业全景图(美柏医健)
接力信达,传奇生物CAR-T疗法能逆袭成功“出海”?(药智网)
国产创新药再次叩关FDA:传奇生物CAR-T美国上市倒计时(医谷)
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..