新药上市申请,代表着生物制药行业过去数年的阶段性研发成就。目前一些进入到关键晚期新药预计在2022年迎来上市,部分药物已提交了上市申请并获得监管机构的受理/审评中。
01 免疫疾病
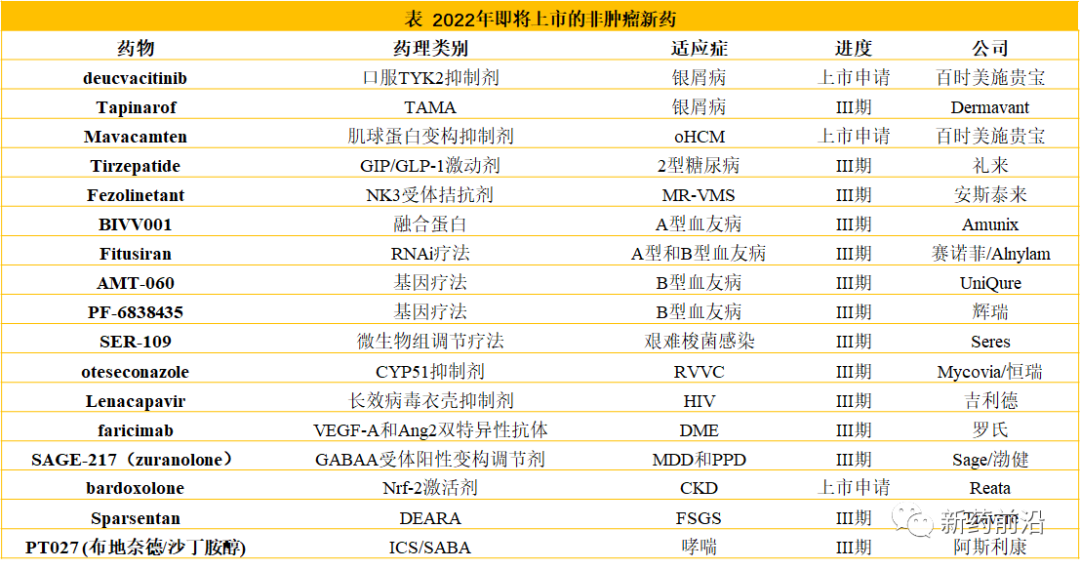
百时美施贵宝的口服TYK2抑制剂deucvacitinib已在银屑病患者中显示出与TNF-α抑制剂相媲美的疗效,如果最终获批,将会成为生物制品(或生物类似药)注射剂最大竞争者。TYK2是JAK家族的成员,但作为变构抑制剂deucvacitinib对TYK2具有高度选择性。通过强调机制方法的独特性,百时美施贵宝希望避免JAK1选择性抑制剂的黑框警告和实验室监测。然而,这项证明可能是困难的,因为在关键的POETYK PSO-1和-2试验中,在deucvacitinib治疗的患者中发现了两次静脉血栓栓塞事件。无论如何,随着deucravacitinib显示出优于磷酸二酯酶4(PDE4)抑制剂Otezla(阿普斯特),百时美施贵宝已于11月29日向FDA提交deucvacitinib上市申请,目标是使该药成为银屑病领域的第一大口服品牌。
Dermavant公司的Tapinarof是一种每日一次非类固醇的芳烃受体调节剂(TAMA)。这种潜在的新型药物被配制成一种理想的乳膏,将为医生和患者提供一种新的局部治疗选择。目前,皮质类固醇和维生素D衍生物是治疗银屑病的首选外用药物,然而,外用类固醇的长期使用受到皮肤萎缩风险的限制。尽管在银屑病患者的III期PSOARING1和2研究中,tapinarof与安慰剂相比表现良好,但缺乏活性对照药可能会限制该药物的潜力。Dermavant预计在2021年中期提交NDA。
02 心血管疾病
百时美施贵宝的Mavacamten是一种肌球蛋白变构抑制剂,可降低有症状的阻塞性肥厚型心肌病(oHCM)患者的心脏收缩力。Mavacamten在有症状的oHCM患者中进行的III期试验显示,具有包括症状(NYHA功能等级)和功能(峰值VO2)测量复合结果的患者比例显著增加。目前还没有专门批准用于oHCM的药物,在美国,mavacamten已获得孤儿药和突破性药物认定,处方药用户收费法(PDUFA)目标日期定为2022年1月28日。欧洲药品管理局(EMA)已受理mavacamten的营销授权申请(MAA)。
03 内分泌疾病
礼来的tirzepatide预计将成为第一个获批用于治疗2型糖尿病的GIP/GLP-1双靶点激动剂。tirzepatide的III期结果显示比目前批准的最有效GLP-1激动剂Ozempic(司美格鲁肽)的最高剂量具有更好的血糖控制和体重减轻,有望在2022年获得批准。Tirzepatide作为一种注射剂,与其他注射型GLP-1激动剂一样,将面临来自Rybelsus(第一个口服GLP-1激动剂)和其他潜在的口服候选药物的竞争。tirzepatide仍然很可能成为重磅炸弹,尽管其销售额的很大一部分可能来自蚕食礼来自己的Trulicity(度拉糖肽)。
安斯泰来的fezolinetant是一种每日一次的口服神经激肽3(NK3)受体拮抗剂,作用于控制体温的特定神经元以模拟雌激素的作用,使其适合治疗更年期相关的血管舒缩症状(MR-VMS)。该药物正在进行关键的III期SKYLIGHT临床试验研究,用于治疗中度至重度MR-VMS。SKYLIGHT 1和2试验的正面顶线结果于2021年1月和2月公布,但发布的细节最少。对于这两项试验,安斯泰来都报告说,30毫克和45毫克的剂量都达到了共同主要终点,即第4周和第12周血管舒缩症状(VMS)的频率和严重程度。这样,安斯泰来满足了FDA的四项共同主要终点要求。总体而言,fezolinetant的前景似乎是积极的,其获批MR-VMS的可能性比较高。竞争对手KaNDy Therapeutics的NT-814处于IIb期SWITCH-1试验中。有利的是,fezolinetant有望比NT-814更快地完成III期,后者在2021年启动III期研究。
04 血液疾病
Amunix公司通过其专有XTEN半衰期延长技术开发的A型血友病新型融合蛋白药物BIVV001,半衰期从普通重组fVIII的13.2小时提高到了42.5小时。BIVV001预计在2022年1月进行的III期XTEND-1试验取得积极结果,目前的时间表表明该药物将有望在2022年下半年获得FDA批准,并可能在2022年底推向市场。该药在欧盟获得批准预计要到2023/24年。
在2021年12月美国血液学会(ASH)年会上,赛诺菲与Alnylam公司公布了其联合开发的RNAi疗法Fitusiran预防治疗A型和B型血友病患者的疗效和安全性的Ⅲ期研究首批结果,达到了所有关键的主要和次要终点。然而,Fitusiran一直受到安全问题的困扰,这可能会阻止其在计划于2022年上市后的应用。
UniQure的基因疗法AMT-060预计在2022年第一季度向FDA提交该药物的上市申请,并将成为血友病领域第一个上市的基因疗法。该药物在IIb期试验和III期HOPE-B试验的中期数据中显示出令人印象深刻的疗效。基因疗法的推出将导致重度B型血友病患者的治疗模式发生转变。
辉瑞的基因疗法PF-6838435显示了令人印象深刻的疗效数据。重要的是,PF-06838435的优势在于拥有四年的长期安全性和疗效数据。PF-6838435的III期26周中期数据预计将于近期公布。假设26周和52周数据为阳性,辉瑞将在UniQure的AMT-061上市后一年内获得PF-06838435的批准。
05 感染疾病
Seres Therapeutics公司开发的SER-109是一种微生物组调节疗法,处于 III 期开发阶段,用于预防有复发病史的患者的艰难梭菌感染。10月26日,Seres Therapeutics在2021年美国胃肠病学院年度科学会议上,公布了SER-109在其III期临床试验ECOSPOR研究中的最新研究结果。与安慰剂相比,在携带艰难梭菌感染复发(rCDI)风险因子的患者中,包括使用抑制胃酸分泌类药物如质子泵抑制剂或H2受体阻断药物的患者,SER-109能降低rCDI风险。Seres Therapeutics预计将在近期申请该疗法的批准,有望成为第一个获批用于预防艰难梭菌的微生物组疗法铺平道路。
Mycovia/恒瑞开发的oteseconazole是羊毛甾醇脱甲基酶(CYP51)的小分子抑制剂,CYP51是一种参与真菌细胞壁甾醇合成的酶。由于其与CYP51的选择性更强和亲和力更高,与目前对人CYP450酶具有脱靶效应的唑类药物(例如氟康唑)相比,该药有可能提高疗效并降低副作用风险。2021年第二季度,FDA接受了该产品用于治疗复发性外阴阴道念珠菌病(RVVC)的新药上市申请(NDA),PDUFA目标日期为2022年1月27日。如果获批,oteseconazole将成为FDA批准的第一个治疗RVVC的药物。
吉利德的Lenacapavir是一种新型长效病毒衣壳抑制剂,将于2022年被批准用于治疗经历过大量治疗的多类耐药HIV患者,这是一个需求未得到满足的领域,需要新的疗法来使患者能够构建能够诱导稳定病毒学抑制的方案。2021年3月,吉利德和默沙东建立了合作伙伴关系,以开发islatravir/lenacapavir的双重组合作为长效口服(LAO-可能每月一次)和长效注射(LAI-可能每六个月一次)方案。
06 眼科
罗氏开发的VEGF-A和血管生成素(Ang)2的双特异性抗体faricimab可能很快就会加剧糖尿病性黄斑水肿(DME)市场的竞争。该药物在现有品牌中具有新的作用机制,迄今为止已证明与Lucentis(雷珠单抗)类似的良性安全性。此外,Ⅱ期阶段的数据表明,faricimab提供的视力获益在16周的给药方案中保持不变,并且比每月一次给药Lucentis的结果略好。faricimab目前正在进行两项针对Eylea(阿柏西普)III期试验(LUCERNE和TENAYA),一旦在2022年成功进入市场,很可能成为其直接竞争对手。
07 精神疾病
Sage/渤健合作开发的SAGE-217(zuranolone)是一种口服神经活性类固醇(NAS)γ-氨基丁酸A(GABAA)受体阳性变构调节剂(PAM),用于重度抑郁症(MDD)和产后抑郁症(PPD)未满足的临床需求。SAGE-217提供了按需、2周、每日一次的治疗方案,zuranolone治疗可在几天内迅速缓解抑郁症状,可能代表着当前抑郁管理方面的一个突破。两家公司计划在2022年下半年向美国FDA提交zuranolone的新药申请(NDA),用于治疗重度抑郁症(MDD);之后,计划在2023年上半年提交另一份申请,用于治疗产后抑郁症(PPD)。
08 肾病
Reata公司开发的新型核调节因子(Nrf-2)激活剂bardoxolone有望成为美国FDA批准的第一种治疗由Alport综合征引起的慢性肾病(CKD)的药物,PDUFA日期为2022年2月25日。Reata于2021年第四季度向EMA提交营销授权申请(MAA)。在第100周和第104周,采用eGFR测定,与安慰剂组相比,bardoxolone治疗组患者的肾功能在统计学上有显著改善。bardoxolone耐受性良好,其安全性与先前试验中观察到的相似。
Travere公司的Sparsentan是一种双效内皮素-血管紧张素受体拮抗剂(DEARA),这是一种新型药物,可双重阻断内皮素A型(ETA)和血管紧张素II 1型(AT1)受体。在原发性局灶节段性肾小球硬化(FSGS)的关键III期研究中,sparsentan显示出比ARB厄贝沙坦更强的蛋白尿部分缓解作用。Travere预计将于近期提交NDA申请。如果获批,sparsentan将成为第一个用于治疗FSGS新型药物,目前对原发性FSGS的治疗包括ACEI/ARB、皮质类固醇和其他免疫抑制疗法。
09 呼吸疾病
阿斯利康评估皮质类固醇(ICS)和短效β-2激动剂(SABA)吸入组合产品PT027(布地奈德/沙丁胺醇)治疗哮喘的三项III期研究的结果相续公布:可显著改善肺功能,降低严重恶化风险。哮喘治疗指南的最新变化有利于布地奈德/沙丁胺醇组合的应用,而传统上使用的是SABA吸入剂。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..