癌症一直是一个全球性的健康问题。根据国际癌症研究机构发布的《2020年全球癌症》,2020年全球约有1930万新癌症病例和近1000万例癌症患者死亡。
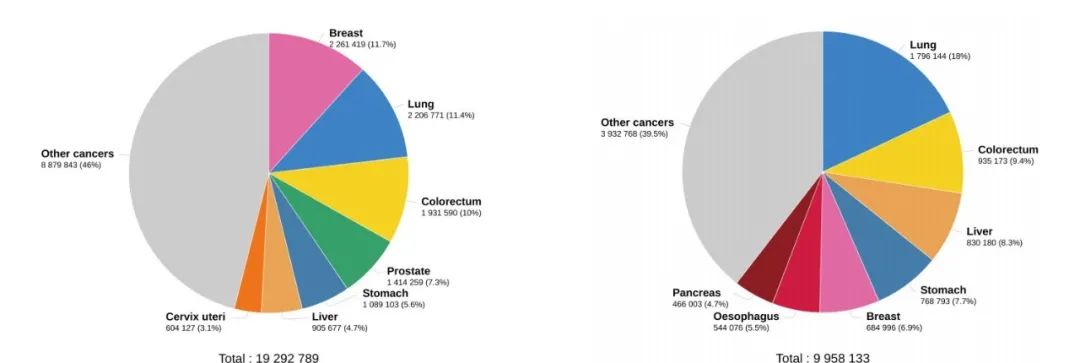
注:左图为2020年肿瘤新病例估计数
右图为2020年肿瘤估计死亡人数
数据来源:GLOBCAN 2020
图形来源:Global Cancer Observatory
目前,患者有多种治疗方法可供选择,包括化疗、靶向治疗和免疫治疗等。
靶向治疗:使用是一种能够靶向控制癌细胞生长、分裂和扩散的蛋白质的精准药物。其中,BRAFV600E突变、BCR-ABL融合蛋白、HER-2和表皮生长因子受体(EGFR)是靶向治疗的一些重要靶点。大多数靶向药物大致可分为两类,包括小分子抗体和单克隆抗体。例如,罗氏王牌生物制剂Herceptin(trastuzumab)是一种美国FDA批准的单克隆抗体,主要用于治疗某些过表达HER-2间的乳腺癌和胃癌患者,而阿斯利康另一款美国FDA批准的酪氨酸激酶抑制剂Iressa(gefitinib)则是一种一线治疗用于转移性非小细胞肺癌的小分子药物,该药物主要针对EGFR第19外显子缺失或第21外显子(L858R)替代突变。
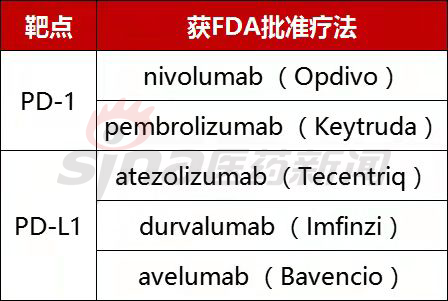
免疫疗法:利用的是患者自身免疫系统对抗癌症的能力。免疫治疗是多种实体肿瘤的第一线治疗选择,而免疫系统的检查点蛋白也可以被认为是有效的治疗靶点。例如,程序性细胞死亡蛋白1(PD-1)是人体免疫T细胞表面的检查点蛋白,程序性死亡配体1(PD-L1)则是在肿瘤细胞表面过表达的免疫检查点蛋白。PD-1和PD-L1之间的相互作用,使得肿瘤细胞能够逃避T细胞介导的免疫应答。目前,几种基于抗体的PD-1/PD-L1阻断疗法已经证明了对几种人类常见肿瘤的治疗存在益处,美国FDA目前已经批准的针对免疫检查点的治疗性抗体如下表所示。
表1:FDA批准的PD-1和PD-L1治疗方法
除此之外,研究人员目前也正在积极研究新的靶点,包括具有Ig和EM结构域的T细胞免疫受体(TIGIT)。在小鼠癌症模型中,共同阻断TIGIT和PD-L1的抗体可增强CD8+T细胞效应功能,抑制肿瘤生长。
2021年1月,罗氏基于II期CITYSCAPE试验的数据,宣布tiragolumab(一种抗TIGIT抗体)和atezolizumab联合使用,在pd-L1阳性转移性非小细胞肺癌中显示出了令人鼓舞的疗效和安全性。
目前来看,单独使用小分子靶向治疗和免疫治疗均显示出良好的临床效果。此外,这两种方法的结合使用也有可能在患者中产生协同和更加持久的治疗结果。例如,一项联合dabrafenib(靶点为BRAFV600E)、trametinib(靶点为BRAFV600E或V600K或V600K)和pembrolizumab进行的随机II期临床试验结果显示,与单独接受三种药物的患者相比,联合用药在改善无进展生存期和增强反应存在优势,不过三联用药的患者也显示出了不良反应的增强。
01 重组药物靶蛋白
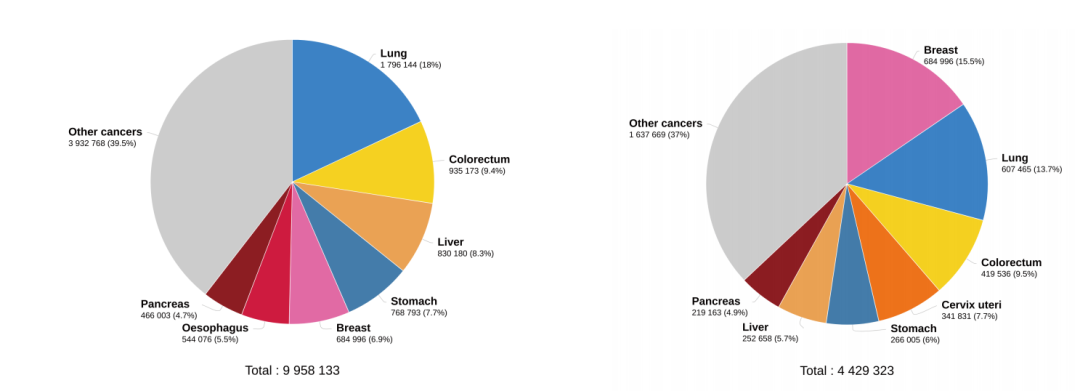
注:左图为2020年全球肿瘤估计死亡人数
右图为2020年女性肿瘤估计死亡人数
数据来源:GLOBCAN 2020
图形来源:Global Cancer Observatory
根据数据统计,肺癌是全球男性和女性癌症死亡的主要原因,2020年预计有180万人死亡(占比18%),其次是结直肠(占比9.4%)、肝脏(占比8.3%)和胃部(占比7.7%)。非小细胞肺癌(NSCLC)则是其中最常见的肺癌类型。在全球范围内,乳腺癌是女性中最致命的癌症(占比15.5%)。EGFR与许多人类恶性肿瘤的发病机制有关,包括头颈部鳞状细胞癌(HNSCC)、NSCLC、结肠直肠癌(CRC)和乳腺癌。为此,美国FDA也已经批准了多项针对这些类型肿瘤的EGFR抑制剂。EGFR配体阻断抗体cetuximab和panitumumab可以靶向EGFR的胞外结构域,而gefitinib和erlotinib是酪氨酸激酶抑制剂,可与EGFR的胞内结构域相互作用。未来,生物制药市场上有望设计出更多包含这些蛋白的胞外或胞内结构域产品。
A.人类EGFR His标签(AA 25-645)
B.人类EGFR His和GST标签(AA668-1210)

图注:含有蛋白质胞外结构域或胞内结构域的产物
(A)EGF与EGFR的结合试验:以2µg/ml的浓度固定化的人EGF hFc(Cat:10605-H01H),可结合人EGFR His(Cat:10001-H08H)
(B)EGFR(AA668-1210)的比活性测定方法
除此之外,肿瘤细胞为了保护自己,还可以通过远离免疫细胞,来逃避患者体内免疫系统的检测。这一过程是通过配体-受体结合激活信号通路来实现的。受体-配体的相互作用也损害了患者对抗肿瘤的免疫力。例如,在许多癌症类型中,CD47(配体)与信号调节蛋白a(SIRPa)受体的结合,会触发了一个抑制性信号通路,使得恶性细胞能够逃脱巨噬细胞的吞噬消除,而一些免疫检查点治疗性抗体则能够通过阻断配体-受体的结合来增加患者的抗肿瘤活性。
目前,阻断PD-1及其配体PD-L1的治疗性抗体已被科学研究证明具有临床疗效,而抗CD47抗体也可以通过阻断CD47与SIRPa的结合来增强患者机体对于肿瘤细胞的吞噬作用。因此,在试验设计支持以及相关研究的工具时,充分考虑到配体-受体配对试验造成的影响是十分重要的。
02 细胞因子
在部分抗体的功能分析时可能还需要在细胞上进行测试,而在这种情况下通常就会使用细胞因子来解决。例如,在T细胞和NK细胞上表达的TIGIT是抗肿瘤效应因子,而TIGIT能够抑制NK细胞对肿瘤细胞的杀伤作用,进一步阻断TIGIT可恢复NK和T细胞的功能。在进行NK细胞和TIGIT阻断功能测定时,添加细胞因子IL-12或细胞因子混合物(IL-12、IL-15 和 IL-18)可以实现刺激NK细胞的效果。目前,市面上已经开发了一系列细胞因子,以便支持研发人员进行和完成各种功能测定。
参考来源(往下滑动查看更多):
1. Hyuna Sung et al., “Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in185 Countries,” CA: A Cancer Journal for Clinicians n/a, no. n/a, accessed February 7, 2021, https://doi.org/10.3322/caac.21660.
2. “Targeted Therapy for Cancer - National Cancer Institute,” cgvArticle, August 15, 2014, nciglobal,ncienterprise,https://www.cancer.gov/about-cancer/treatment/types/targeted-therapies.
3. William N. Hait, “Targeted Cancer Therapeutics,” Cancer Research 69, no. 4 (February 15, 2009): 1263–67,https://doi.org/10.1158/0008-5472.CAN-08-3836.
4. Lei Zhong et al., “Small Molecules in Targeted Cancer Therapy: Advances, Challenges, and Future
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..