今日,罗氏旗下基因泰克公司宣布美国FDA已批准其创新疗法Vabysmo (faricimab-svoa)上市,治疗湿性年龄相关性黄斑变性(AMD)和糖尿病性黄斑水肿(DME),这两种疾病是美国成年人主要的视力丧失原因。新闻稿指出,这是首款获FDA批准治疗这两种眼科疾病的双特异性抗体。
作为一款双特异性抗体,Vabysmo同时靶向阻断两条致病关键通路——血管生成素-2(Ang-2)和血管内皮生长因子-A(VEGF-A),这两种通路都能破坏血管的稳定性,使血管发生渗漏,增加炎症的发生,从而驱动许多可导致视力丧失的视网膜疾病。同时靶向这两条通路可以起到一定的互补作用,因此Vabysmo有望稳定血管,改善患者的视力。
该疗法的获批是基于4项3期临床试验中取得的积极结果,其中两项针对湿性AMD患者,另两项针对DME患者。所有试验均达到其主要终点,显示与每2个月给药一次的当前标准治疗相比,每4个月给药一次Vabysmo达到非劣效性标准的视力获益。公布临床试验结果时的新闻稿指出,Vabysmo是首个在湿性AMD和DME的3期临床试验中,达到如此持久疗效的眼部注射药物。安全性方面,在所有4项试验中,Vabysmo通常耐受良好,未发现新/非预期安全性信号。去年7月,美国FDA接受了其生物制品许可申请(BLA),并授予优先审评资格。
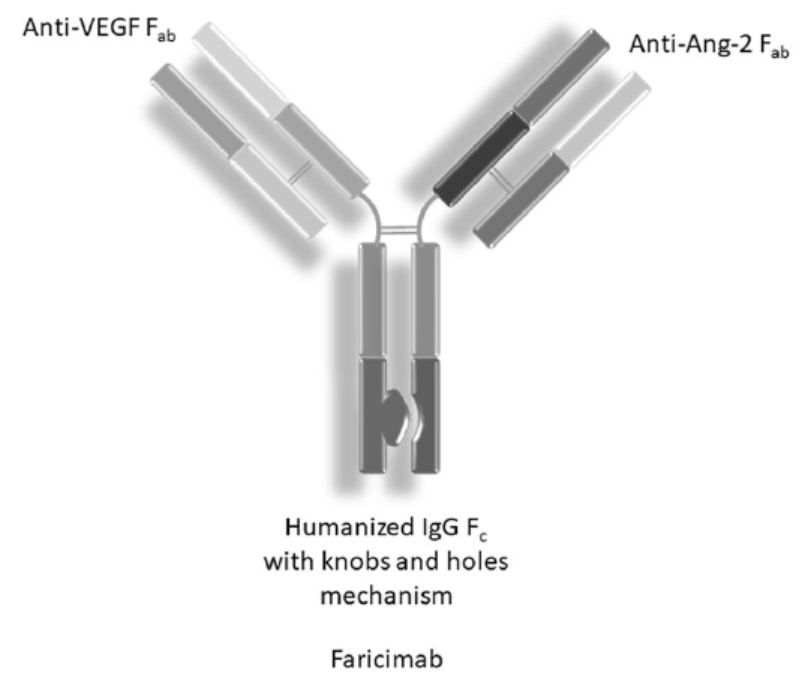
▲Faricimab结构示意图(图片来源:参考资料[2])
一份Clarivate的报告指出Vabysmo有望在未来五年成为重磅疗法。目前这两大疾病的标准疗法,每1到2个月就要进行注射。Vabysmo相较标准疗法,给药的频率更低,因此可能更为便捷。
“Vabysmo提供了一种全新方法,通过一种同时靶向两条通路的机制,治疗威胁视力的视网膜疾病,”基因泰克首席医学官兼全球产品开发负责人Levi Garraway博士说道,“这是我们在近几个月来获FDA批准的第二款眼科疗法,强调了我们对于患有视网膜疾病的患者的承诺。”
参考资料:
[1] FDA Approves Genentech’s Vabysmo, the First Bispecific Antibody for the Eye, to Treat Two Leading Causes of Vision Loss, Retrieved January 28, 2022, from https://www.businesswire.com/news/home/20220128005009/en
[2] Sharma et al., (2019). Faricimab: expanding horizon beyond VEGF. Eye, https://doi.org/10.1038/s41433-019-0670-1
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..