艾伯维(AbbVie)的摇钱树Humira/修美乐(阿达木单抗)将于2023年在美国专利到期,面临生物类似药的竞争。该疗法在2020年达到203.9亿美元销售额,连续第七年成为全球“药王”。
该公司的Janus激酶(JAK)抑制剂Rinvoq(乌帕替尼)和白细胞介素-23拮抗剂Skyrizi(risankizumab-rzaa)被认为最具弥补修美乐专利悬崖的新产品。
因此,这两种药物的销售预测受到密切关注。
艾伯维近日发布预测,Rinvoq和Skyrizi两种药物2025年的总销售额预计为150亿美元,该预测数值与此前一致,不过单个产品的预测出现了一些变动。该公司将Rinvoq销售额降低了5亿美元,而将Skyrizi的销售额增加了相同的金额。
艾伯维现在预计2025年Rinvoq的风险调整后销售额将超过75亿美元,Skyrizi将超过75亿美元。
对Rinvoq的调整是基于其标签上的警告。该药物在美国被批准用于类风湿性关节炎,去年12月获得了第二个适应症银屑病关节炎的批准。作为JAK抑制剂类的药物,Rinvoq的新标签将限制其使用于已经尝试过TNF抑制剂药物类别药物的患者,而以前该药可以在TNF之前使用。
虽然FDA的安全性警告将削弱Rinvoq在美国的销售额,但艾伯维解释说存在抵消因素,因为Rinvoq在溃疡性结肠炎和克罗恩病的Ⅲ期研究中的积极结果,预计全球销售额预期会更高。
该公司表示:“从安全性和有效性的角度来看,我们获得Rinvoq用于溃疡性结肠炎和克罗恩病的数据都超出了我们的预期。”
此外,艾伯维表示,Skyrizi调整后的指导是其在银屑病领域持续强劲表现的结果。
与此同时,艾伯维近日表示,预计Rinvoq和Skyrizi未来将涵盖Humira的所有适应症以及特应性皮炎。
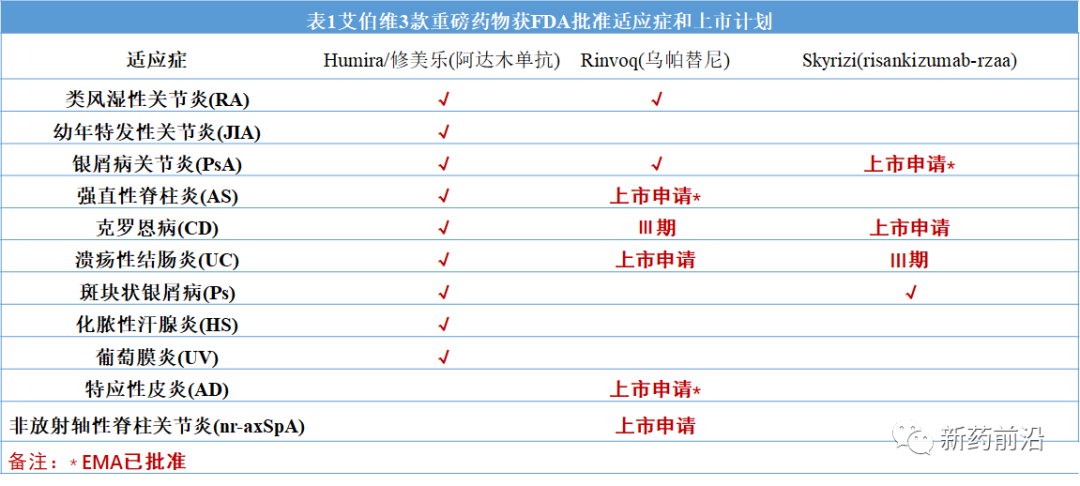
目前这两种药物在欧美上市申请计划如下:
Rinvoq尚未获得美国食品药品监督管理局(FDA)的批准用于治疗特应性皮炎或强直性脊柱炎,艾伯维对这些适应症的监管申请目前正在审查中。Rinvoq尚未获得FDA或欧洲药品管理局(EMA)的批准艾伯维对Rinvoq治疗溃疡性结肠炎和非放射轴性脊柱关节炎的监管申请,目前正在FDA和EMA审查中。
Skyrizi尚未被FDA批准用于银屑病关节炎,对该适应症的监管申请目前正在审查中。Skyrizi尚未被FDA或EMA批准用于克罗恩病或溃疡性结肠炎。克罗恩病目前正在由FDA和EMA审查中。
因此,艾伯维的首席财务官Rob Michael表示:“我们完全相信,销售高峰期的Rinvoq和Skyrizi整体销售额将超过Humira(就销售额而言)。”
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..