▎药明康德内容团队编辑
今日,LEO Pharma宣布,美国FDA已批准IL-13抑制剂Adbry(tralokinumab),用于治疗18岁或以上、疾病无法通过局部处方疗法充分控制或治疗的中重度特应性皮炎成人患者。Adbry可选择是否与外用皮质类固醇联用。新闻稿指出,Adbry是美国FDA批准的首款能够特异性结合并抑制IL-13细胞因子的生物制品,这是特应性皮炎的关键驱动因子。
这也是美国FDA在2021年批准的第50款新药。
特应性皮炎是一种慢性炎症性皮肤疾病,主要症状为严重瘙痒和湿疹性病变。全球有超过两亿患者受到这一疾病的困扰。它能够导致严重瘙痒、失眠和由于可见病变带来的社会压力,对患者的生活质量产生严重的负面影响。特应性皮炎产生的原因是由于皮肤屏障功能障碍和免疫失调。近年来的研究发现,特应性皮炎患者的皮肤组织中多种细胞会过度表达IL-13。
Adbry是一款与IL-13高亲和力结合的全人源化单克隆抗体。它不但能够阻断IL-13与IL-13Rα1的结合,还能够阻断IL-13与IL-13Rα2的结合。它最初由阿斯利康(AstraZeneca)公司开发,LEO Pharma在2016年与阿斯利康达成协议,获得Adbry的全球开发权益。
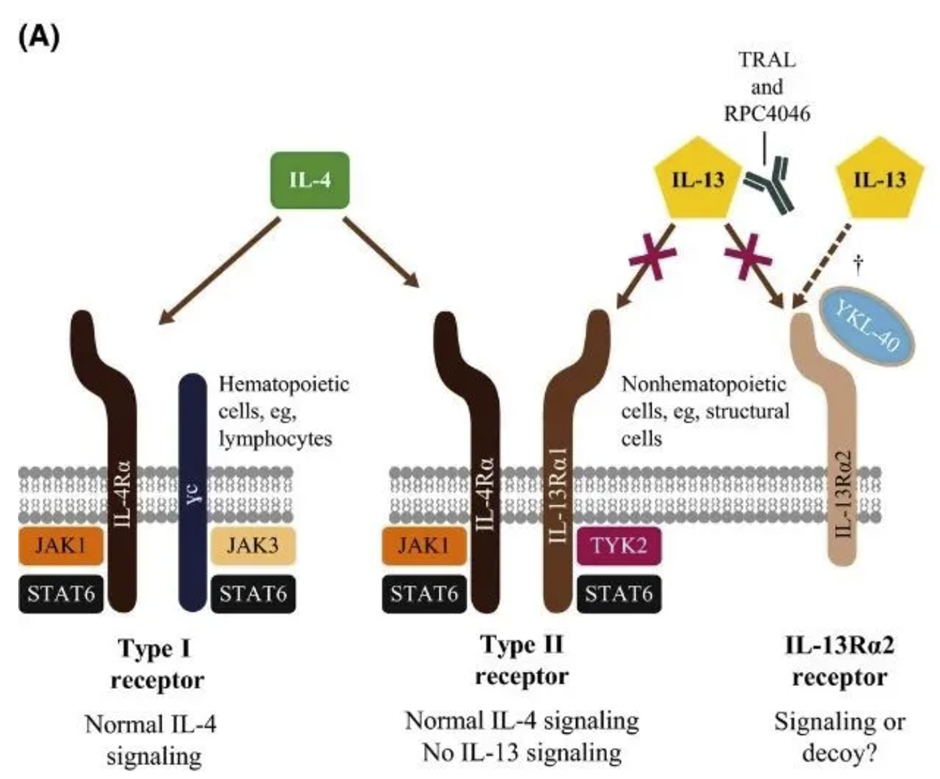
▲Adbry(图中的TRAL)通过与IL-13结合,阻断它与IL-13Rα1和IL-13Rα2的结合(图片来源:参考资料[2])
Adbry本次获批是基于3项关键性3期试验的积极安全性和疗效结果,共入组约2000例中重度特应性皮炎成人患者。而安全性数据评估来自5项随机双盲、安慰剂对照试验获得的数据,除了以上3项3期临床试验外,还包括一项剂量探索试验和一项疫苗应答试验。
所有3项关键性试验均在第16周时达到其主要终点,即与安慰剂相比,Adbry(300 mg,每2周1次单药治疗,或根据需要联合外用皮质类固醇治疗)达到EASI 75(湿疹面积和严重程度指数比基线改善75%及以上),或IGA评分达到0或1(代表皮肤症状完全或接近完全清除)的患者比例显著更多。并且,在每日瘙痒NRS应答(≥4分)的关键次要终点上,Adbry组也明显优于安慰剂组。
在安全性方面,Adtralza在治疗过程中表现出良好的耐受性,不良事件的总体频率与安慰剂相当。最常见的不良事件为上呼吸道感染(主要报告为普通感冒)、结膜炎、注射部位反应和嗜酸性粒细胞增多。
“今天FDA批准Adbry,对于LEO Pharma和数百万患有中重度特应性皮炎的患者来说都是一个重大的里程碑。”LEO Pharma的首席财务官兼代理首席执行官Anders Kronborg先生表示,“作为我们在美国(获批)的首个生物制品,Adbry标志着我们推进医学皮肤病学护理标准这一使命的重要进展。”
参考资料:
[1] LEO Pharma announces FDA approval of Adbry™ (tralokinumab-ldrm) as the first and only treatment specifically targeting IL-13 for adults with moderate-to-severe atopic dermatitis. Retrieved December 28, 2021, from https://www.businesswire.com/news/home/20211227005159/en
[2] Bieber (2020), Interleukin-13: Targeting an underestimated cytokine in atopic dermatitis. Allergy, DOI: 10.1111/all.13954
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..