11月1日,Incyte宣布,美国FDA已受理其在研高活性、高选择性的新一代口服磷脂酰肌醇3-激酶δ (PI3Kδ)抑制剂parsaclisib的新药上市申请(NDA),用于治疗复发或难治性滤泡性淋巴瘤(FL)、边缘区淋巴瘤(MZL)和套细胞淋巴瘤(MCL)。

FDA还授予parsaclisib优先审评资格,用于既往接受过至少一种基于抗CD20治疗方案的复发或难治性MZL成人患者,以及既往接受过至少一种治疗方案的MCL成人患者,预定的PDUFA日期为2022年4月30日。parsaclisib用于已接受至少两种既往全身治疗的复发性或难治性FL成人患者NDA预定的PDUFA日期为2022年8月30日。
此项NDA申请是基于parsaclisib治疗复发或难治性滤泡性(CITADEL-203)、边缘区(CITADEL-204)和套细胞性(CITADEL-205)淋巴瘤患者的多项II期研究积极结果(见下表)。parsaclisib在所有研究中均具有良好的耐受性和可管理的安全性。
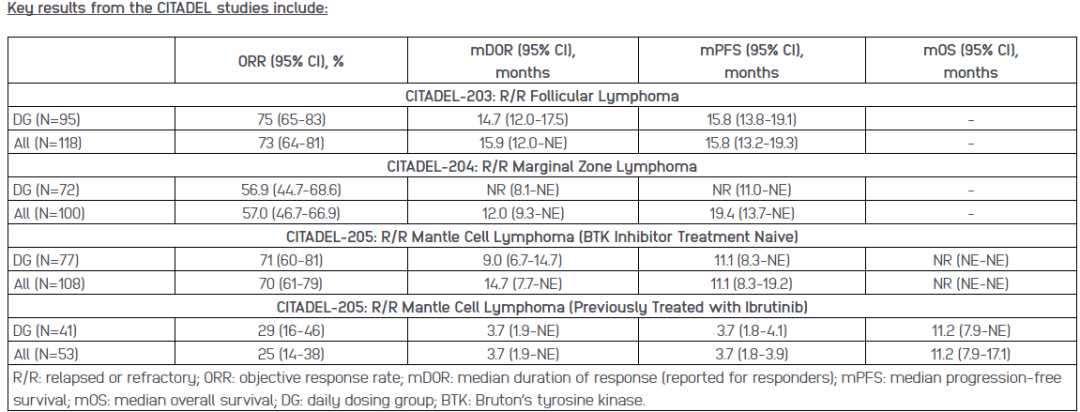
Parsaclisib用于MCL (CITADEL-310)、复发或难治性FL和MZL (CITADEL-302)的III期验证研究正在准备中。
2018年12月,信达生物与Incyte就parsaclisib以及pemigatinib(FGFR1/2/3抑制剂)、itacitinib(JAK1抑制剂)达成战略合作,获得了这3款药物在中国大陆及港澳台的开发和商业化权利。在国内,parsaclisib已获得CDE突破性疗法认定,用于治疗复发或难治性FL。

非霍奇金淋巴瘤(NHL)是一种始于淋巴细胞的癌症。滤泡性淋巴瘤(FL)、边缘区淋巴瘤(MZL)和套细胞淋巴瘤(MCL)是B细胞性NHLs的几种类型。FL和MZL是属于惰性、生长缓慢的淋巴瘤类型,而MCL属于侵袭性、快速进展的类型。对于复发或初始治疗难治的患者,临床需求仍未得到满足。
“非霍奇金淋巴瘤是美国最常见的癌症之一,FDA接受此项NDA对Incyte和对初始治疗无应答或接受初始治疗后疾病进展的NHL患者来说是一个重要的里程碑,”Incyte肿瘤靶向疗法部副总裁Peter Langmuir医学博士说。“我们期待与FDA合作,将这种创新疗法带给可能受益的患者。”
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..