欧盟于 2021 年 10 月 26 日公布了其《欧盟检查和信息交换程序汇编》更新版本,对汇编中涉及的文件进行了大幅修订和更新。
汇编以前被称为《行政协作和检查协调的共同体程序汇编》,是促进欧盟成员国 GMP 和 GDP 检查员之间合作的工具和实现协调的手段。其中程序为构成国家 GMP 检查机构质量体系部分的国家程序提供了基础。这些质量体系基于汇编文件之一中规定的框架而建立。2010 年 7 月,与分销质量管理规范(GDP)检查相关的文件开始添加到汇编中。
更新后的汇编文件被分为两部分,包括第一部分中的程序和第二部分中的其它文件(例如,监管机构使用的解释文件和模版)。汇编中的文件在获得 GMDP 检查工作组的同意后,由欧盟委员会审查,然后由 EMA 代表欧盟委员会发布。
另外,汇编文件还修订了以下文件:
药品可疑质量缺陷报告的管理和分类以及基于风险的决策 — 该程序经过修订,以便按照质量风险管理原则提供更全面的指导。
由质量缺陷风险评估引起的快速警报管理 — 修订程序以遵循质量风险管理原则提供更全面的指导。
处理严重 GMP 不合规问题需要协调措施时的程序 — 程序已根据被取代程序的经验进行了修订;更新了附录 6:监管风险评估。
第三国生产商 GMP 状态确认协调的程序纲要
基于风险的药物生产商检查规划模型
欧盟 GMP 证书格式解释
欧盟(人用医药产品)批发分销格式解释 — 新程序
欧盟 GMP 证书格式
GMP 证书的颁发和更新 — 次要更新,主要是为了使程序与经验保持一致
来自第三国或国际组织的严重 GMP不合规信息
制药商/进口商许可欧盟格式不符合 GMP解释的声明
合规管理程序 — 新程序
汇编中指出,为促进试验用人用医药产品 GMP 检查的统一,在适当情况下,许多 GMP 程序在经过修改后也适用于试验用药品。医药产品药物警戒检查指南是 EMA 采用的良好警戒实践指南的一部分。GCP 检查指南是 EudraLex 第 10 卷的一部分。
欧盟药品机构(HMA)同意建立 GMP 检查机构联合审计计划,以确证欧洲经济区 GMP 检查机构与写入国家法律的欧洲指令相关条款的实施和等效性,从而保持每个成员国对其他成员国 GMP 检查系统的相互信任。程序汇编提供了审计可能依据的标准。
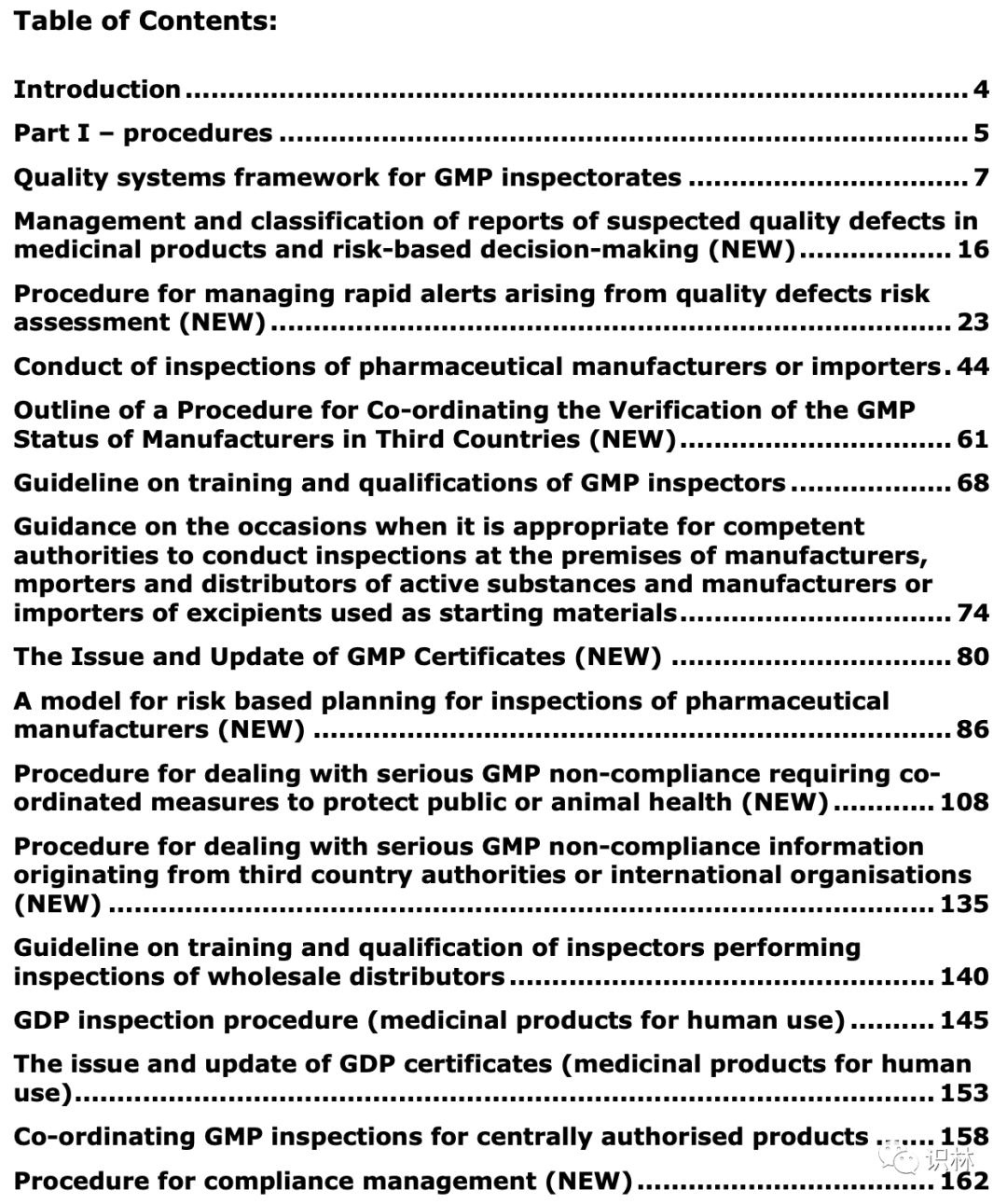
更新后的汇编文件目录如下,文件内容值得仔细研读。

作者:识林-蓝杉
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..