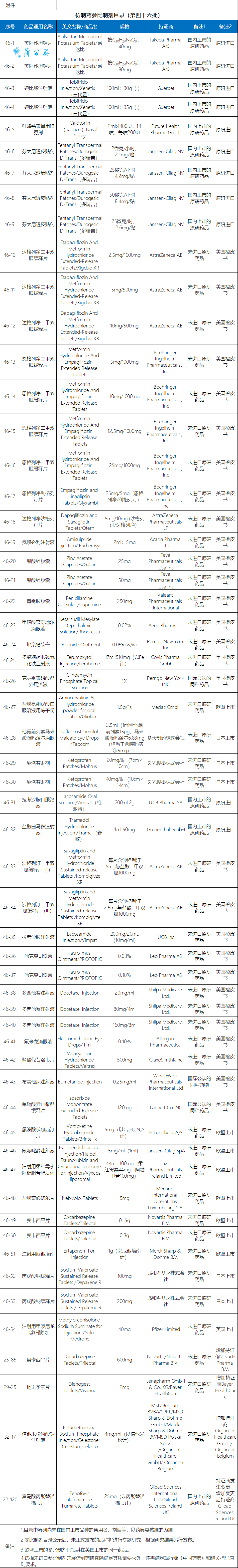
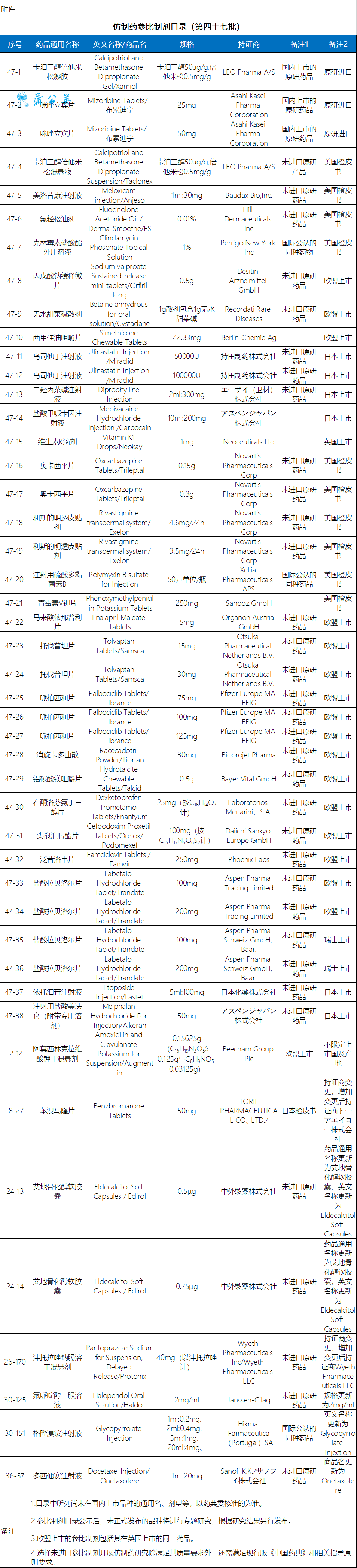
10月20日,国家药监局关于发布两则仿制药参比制剂目录(第四十六批)和(第四十七批)通告。两批共104个仿制药参比制剂,大部分为未进口原研药品、国内上市的原研药品以及美国橙皮书品种。
目录中所列尚未在国内上市品种的通用名、剂型等,以药典委核准的为准。参比制剂目录公示后,未正式发布的品种将进行专题研究,根据研究结果另行发布。欧盟上市的参比制剂包括其在英国上市的同一药品。选择未进口参比制剂开展仿制药研究除满足其质量要求外,还需满足现行版《中国药典》和相关指导原则要求。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..