▎药明康德内容团队编辑
2021年9月16日,由诺奖得主Jennifer Doudna教授联合创建的Intellia Therapeutics公司宣布,美国FDA已接受其CRISPR基因编辑改造的TCR-T细胞疗法NTLA-5001的IND申请,该公司将启动临床试验治疗急性髓系白血病(AML)。
急性髓系白血病是一种血液和骨髓的癌症,如不立即治疗,可迅速致命。是成人急性白血病中最常见的类型,2020年估计新发病例超过2万。尽管目前AML的治疗方法可用,但患者的5年总生存率仍低于30%。AML与其他癌症类型一起,通常表现为肾母细胞瘤1(WT1)抗原的过度表达。
NTLA-5001是一种基于体外CRISPR/Cas9基因组编辑技术的自体T细胞受体(TCR)-T细胞疗法,靶向WT1抗原,用于治疗急性髓系白血病(AML)的所有基因亚型。这种自体细胞治疗候选药物设计用于携带HLA-A*02:01等位基因的AML患者。Intellia计划在既往接受过一线治疗的持续性或复发性AML成人患者中开展一项评估NTLA-5001的1/2a期临床试验,并在年底前启动患者筛选。
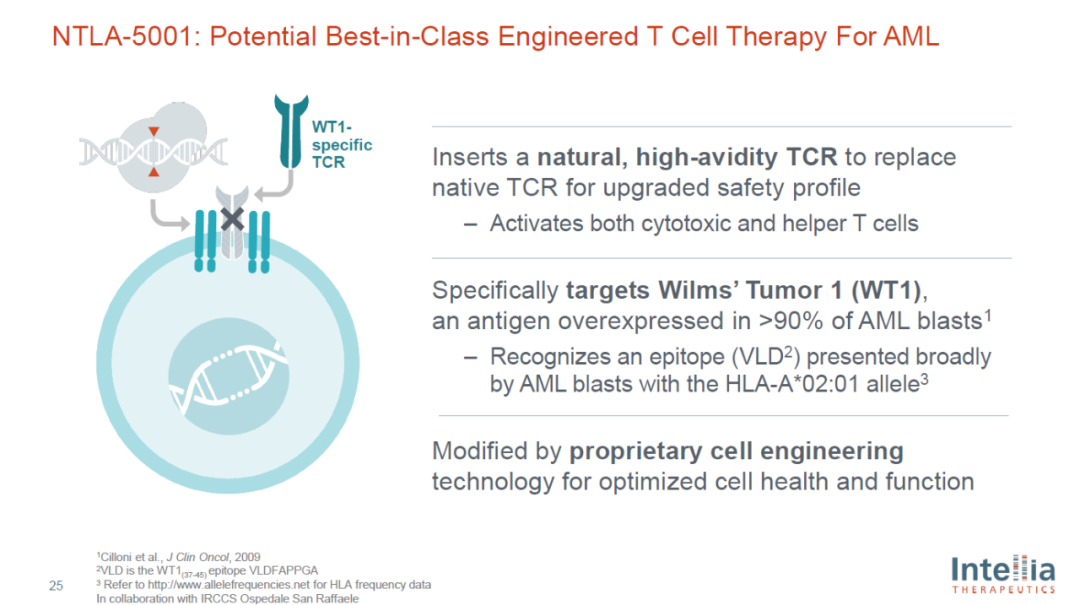
图片来源:Intellia公司官网
“美国FDA接受我们的NTLA-5001的IND是我们利用Intellia专有平台开发先进细胞疗法来治疗癌症患者的一个重要里程碑。我们的治疗策略是利用CRISPR/Cas9基因组编辑技术创建新一代工程化免疫细胞,与之前开发的细胞疗法相比,具有更有效和安全地攻击癌细胞的潜力。”Intellia总裁兼首席执行官John Leonard博士表示。
参考资料:
[1] Intellia Therapeutics Announces U.S. FDA Acceptance of Investigational New Drug Application for NTLA-5001, its CRISPR/Cas9-Engineered TCR-T Cell Candidate for Acute Myeloid Leukemia. Retrieved September 16, 2021, from https://www.globenewswire.com/news-release/2021/09/16/2298323/0/en/Intellia-Therapeutics-Announces-U-S-FDA-Acceptance-of-Investigational-New-Drug-Application-for-NTLA-5001-its-CRISPR-Cas9-Engineered-TCR-T-Cell-Candidate-for-Acute-Myeloid-Leukemia.html
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..