近日,优时比(UCB)公司宣布,欧盟委员会已批准该公司开发的Bimzelx(bimekizumab)上市,用于治疗适合接受全身性治疗的中重度斑块状银屑病患者。新闻稿指出,这是首款获得批准用于治疗银屑病的IL-17A/IL-17F抑制剂。
全人源化单抗bimekizumab,能够强力并特异性地中和IL-17A和IL-17F。IL-17A在斑块状银屑病,银屑病关节炎和强直性脊柱炎的发病机理中起关键作用。IL-17A与IL-17F具有大于50%的结构同源性和重叠的生物学功能。IL-17A和IL-17F在多种发炎的人体组织中均上调,并与其他促炎细胞因子,例如肿瘤坏死因子(TNF)协同作用,放大炎症反应。同时结合这两种细胞因子,阻止它们与细胞表面表达的IL-17受体相互作用,让bimekizumab能更好地发挥抗炎症的功能。
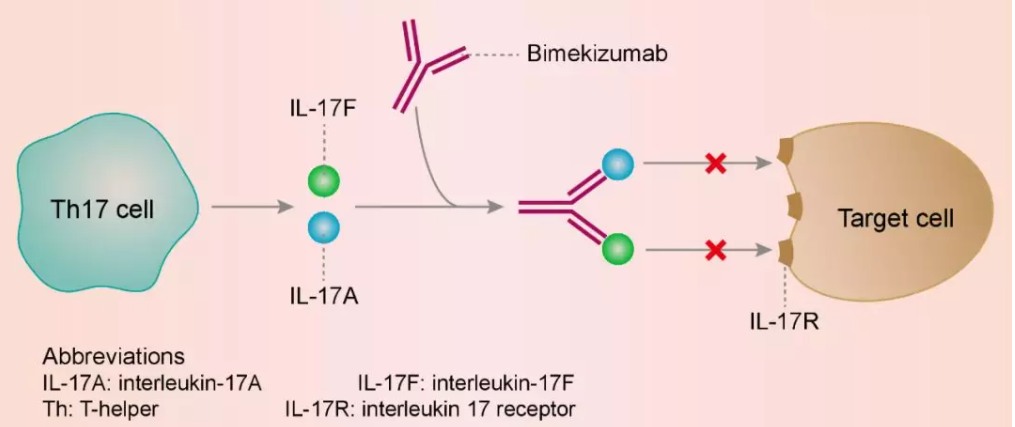
▲Bimekizumab的工作机理示意图(图片来源:参考资料 [2])
这一批准获得三项3期临床试验BE VIVID、BE READY和BE SURE的支持,包含1480名中重度银屑病患者。所有研究均达到试验的共同主要终点和关键性次要终点。接受bimekizumab治疗的患者在皮肤症状清除(PASI 90和IGA 0/1)方面的改善优于常见获批银屑病疗法。而且,在所有研究中,bimekizumab治疗在第16周时获得的临床缓解可以维持长达一年。
(原文有删减)
参考资料:
[1] UCB Announces European Commission Approval of BIMZELX[®]▼ (bimekizumab) for the Treatment of Adults with Moderate to Severe Plaque Psoriasis. Retrieved September 6, 2021, from https://www.ucb.com/stories-media/Press-Releases/article/UCB-Announces-European-Commission-Approval-of-BIMZELX-bimekizumab-for-the-Treatment-of-Adults-with-Moderate-to-Severe-Plaque-Psoriasis
[2] Bimekizumab Overview. Retrieved September 6, 2021, fromhttps://www.creativebiolabs.net/bimekizumab-overview.htm
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..