随着艾伯维(AbbVie)接近制药行业有史以来最大的专利悬崖即将到来——2023年Humira(adalimumab,阿达木单抗)的专利悬崖——该公司的高管们对即将继承该重磅炸弹宝座的免疫药物越来越倚重。
艾伯维的Humira是目前世界上最畅销的药物,从2023年1月开始,它将面临激烈的生物类似药侵蚀。该药物在欧洲已经开始与生物类似药竞争,去年在全球范围内创造了198亿美元销售额,占公司总收入的43%。
在近期美国投资机构伯恩斯坦会议上,艾伯维的副主席兼总裁迈克尔·塞韦里诺(Michael Severino)对旗下的Skyrizi(risankizumab)和Rinvoq(upadacitinib,乌帕替尼)持乐观态度,这两种药物是该公司指望帮助缓解Humira生物类似药带来收入下降的希望。
Rinvoq:适应症扩展屡遭监管障碍
对于Rinvoq,适应症扩展的上市申请现在因JAK抑制剂类安全问题受到困扰:
[1] 3月,Rinvoq治疗活动性银屑病关节炎成人患者适应症补充新药申请(sNDA)的审查期限延长三个月,至2021年第2季度末。
[2] 4月,该药的特应性皮炎适应症补充新药申请的审查期限也被推迟到第3季度初。
[3] 6月25日,FDA再次通知艾伯维,FDA将不会在规定的处方药申报者付费法案(PDUFA)行动日期完成对Rinvoq用于治疗活动性银屑病关节炎和活动性强直性脊柱炎成人患者适应症补充新药申请的审查,这意味着再次遭遇延迟,目前尚未透露新的决定日期。
[4] 7月16日,艾伯维表示,FDA再次推迟了对Rinvoq中重度特应性皮炎申请的决定。公司没有提供该机构决定的更新时间表。
其中,艾伯维设想该药物最初用于三分之一未从竞争对手诺菲重磅特应性皮炎疗法Dupixent(dupilumab,度普利尤单抗)中获得足够益处的患者。从长远来看,艾伯维认为其药物在一线使用中具有竞争力。艾伯维预计,未来几年,价值40亿美元的特应性皮炎市场将增长两倍。
Skyrizi:有“很长的路要走”
至于银屑病药物Skyrizi,艾伯维仍然认为该药物和整个市场都有“很长的路要走”。生物制剂最初的应用接受缓慢,艾伯维认为其药物的安全性和有效性可以与包括强生公司的选择性IL-23抑制剂Tremfya (guselkumab,古塞奇尤单抗)在内的药物竞争。
即使在Humira失去独占权之后,艾伯维相信Skyrizi不会受到更便宜的Humira生物类似药的影响,并且可以“独善其身”。
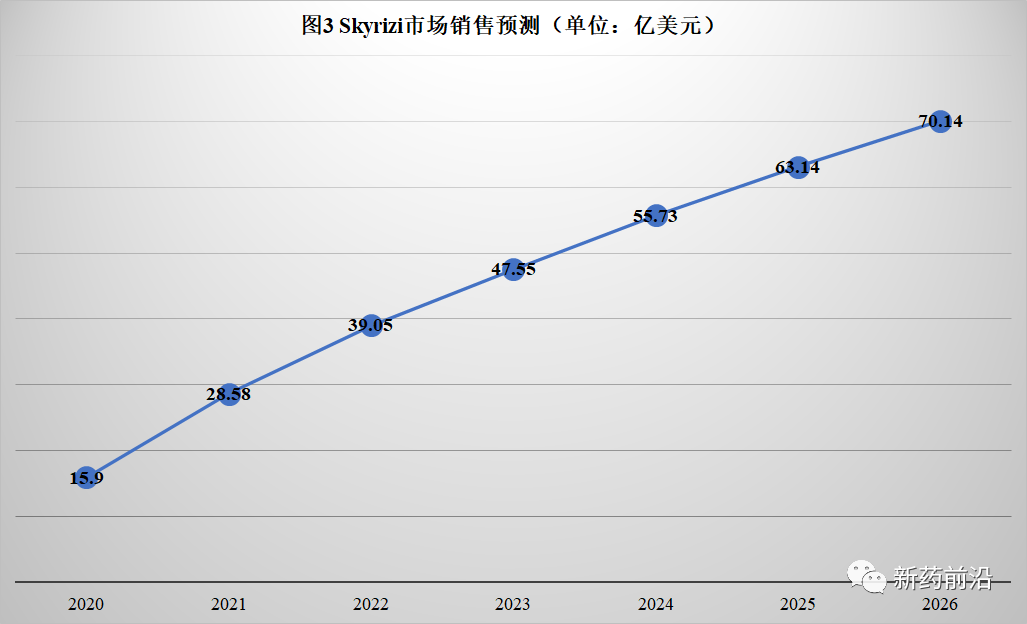
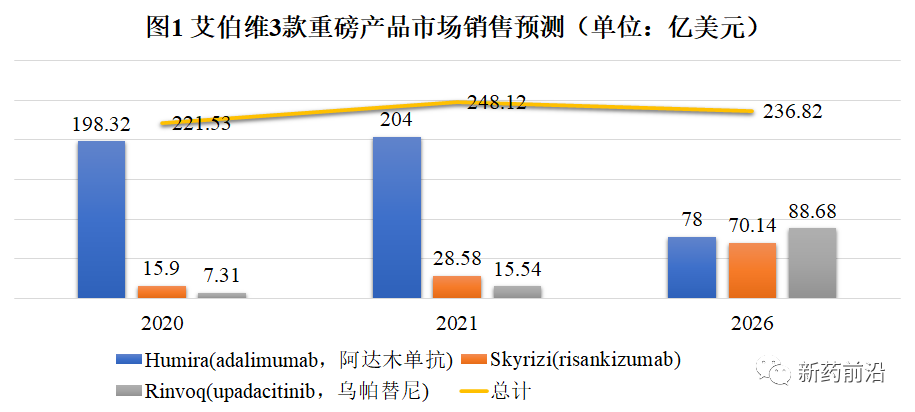
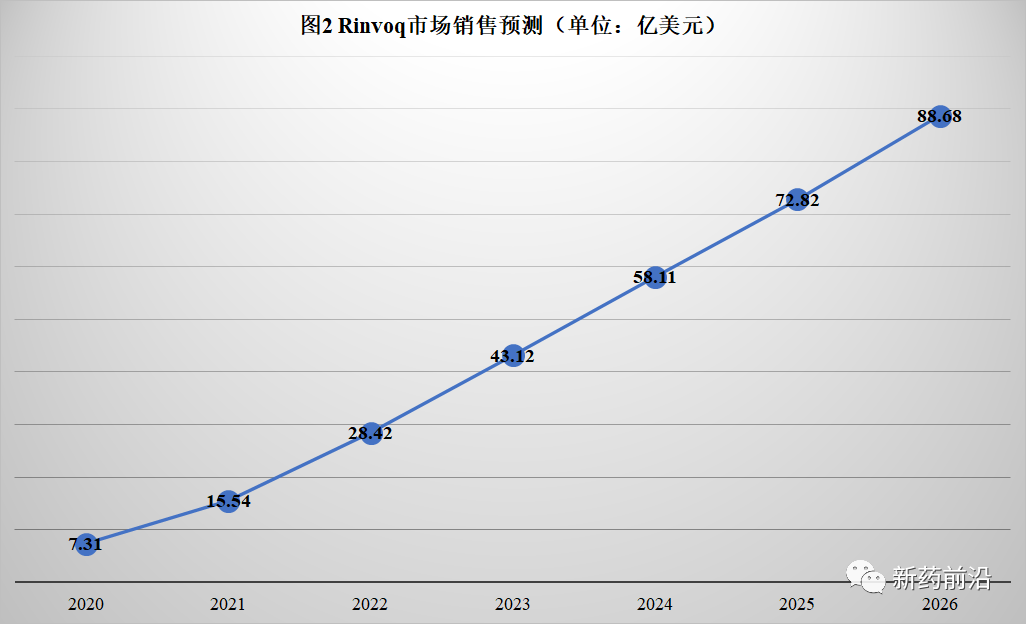
在Humira生物类似药于2023年初进入美国市场后,艾伯维寄希望于Skyrizi和Rinvoq两种药物来接棒Humira。去年,这两种新药的总收入为23亿美元;艾伯维表示,到2025年,两者的市场规模将达到150亿美元。
而医药市场调研机构Evaluate Pharma预测Skyrizi和Rinvoq到2026年销售总额达到158亿美元。届时,三种药物的销售总额(Humira、Skyrizi和Rinvoq)与2020年相比略有增长(增加约15亿美元)。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..