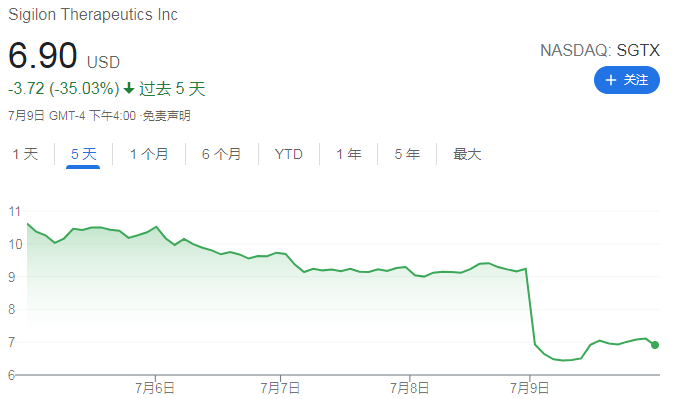
7 月 9 日,Sigilon Therapeutics, Inc.(以下简称 Sigilon 公司)宣布,在公司向 FDA 和其他监管机构提交严重不良事件( SAE)和临时注册停止申请后,FDA 已经暂停其在研的 SIG-001 在重度或中度重度 A 型血友病患者中进行的 1/2 期研究。
受此消息影响,Sigilon 在上周五股票大跌。
根据 Sigilon 公司新闻稿表示,迄今为止,已有三名患者接受了 SIG-001。第三名患者接受了最高剂量的 SIG-001,产生了因子 VIII 的抑制物(特异性中和 FVIII 的抗体),这是 FVIII 治疗的一种众所周知的并发症,可导致体内 FVIII 水平及活性降低。
患者对药物治疗反应良好,病情持续好转。此外,FDA 要求提供可能导致该患者产生抑制物的更多信息或数据,例如家族史和最近接种疫苗的免疫刺激。参与本研究的所有三名患者将继续按照研究方案进行随访,同时公司将调查 SAE。
A 型血友病也被称为因子 VIII(FIII)缺乏或经典血友病,是一种由凝血因子 VIII 缺失或缺陷引起的 X 连锁遗传病,患者会反复发生持续或自发性出血,特别是在关节、肌肉或内脏器官中,长期可导致残疾。目前,重度 A 型血友病的护理标准是每周 2-3 次静脉输注凝血因子 VIII 的预防性治疗方案。
SIG-001 是基于 Sigilon 公司的 Shielded Living Therapeutics™ 平台研发, 作为 A 型血友病患者的潜在新疗法,其目标是持续提供凝血因子以帮助预防出血事件。SIG-001 是一种缓冲悬浮液,由 1.5 mm 藻酸盐球组成,其中包裹着表达 hFVIII 的人类细胞。SIG-001 在临床前研究中观察到的一定的疗效、持久性和可控性。
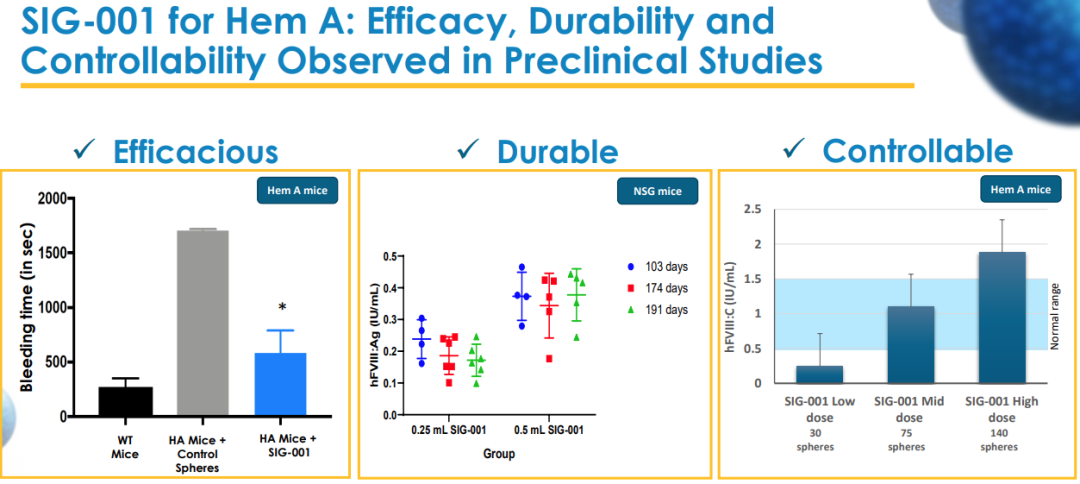
图片来源:Sigilon 公司官网
2019 年 8 月,美国 FDA 授予 SIG-001 治疗 A 型血友病的孤儿药资格认定。2020 年 9 月,Sigilon 启动 SIG-001 首次人体试验 (SIG-001-121),这是一项多中心、开放标签、剂量递增 1/2 期临床研究,用于评估 SIG-001 在无抑制物的成人重症患者中的安全性、耐受性和初步疗效。计划入组 18 名患者,预计到 2026 年完成。
近年来,基因治疗作为一次治疗、长期甚至终身治愈的潜在疗法被广泛关注。据 Insight 数据库显示,目前全球有 7 款用于 A 型血友病的基因疗法进入到临床阶段,其中,BioMarin 的 valoctocogene roxaparvovec 和 Sangamo Therapeutics /辉瑞的 PF 07055480 已经进展到临床 III 期,且在国内同步开展临床中。
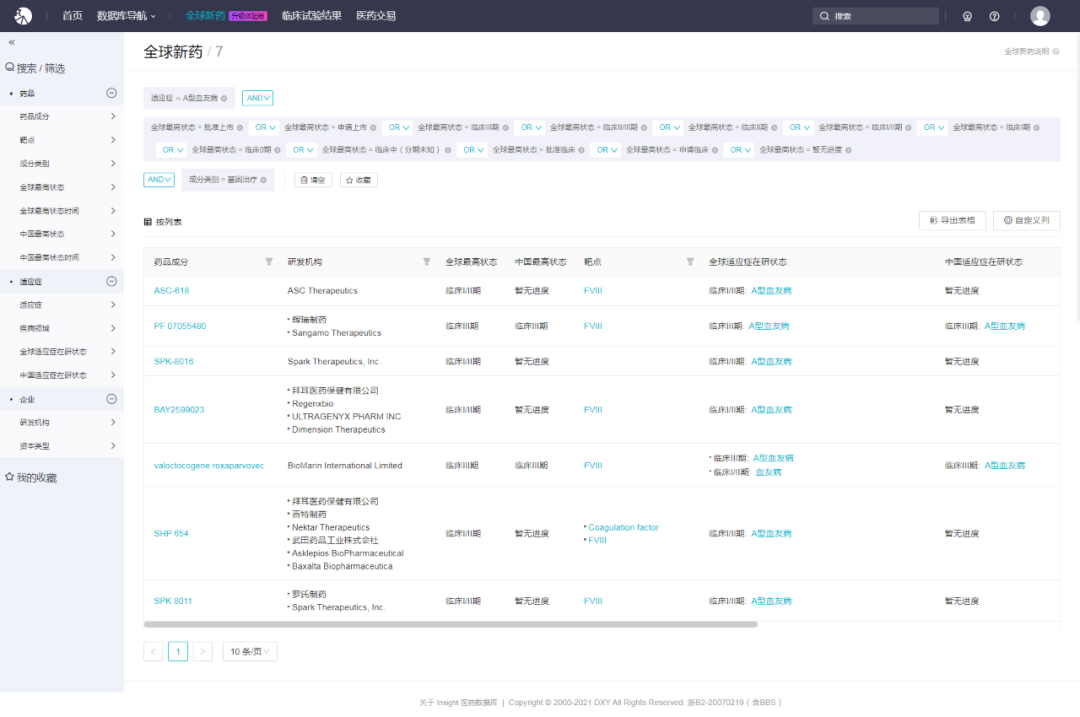
图片来源:Insight 数据库(https://db.dxy.cn/v5/home)
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..