在近日举办的美国临床肿瘤学会(ASCO)虚拟会议上,默沙东详细介绍Keytruda+赫赛汀+化疗组合型治疗胃癌研究结果。默沙东表示,将Keytruda与罗氏赫赛汀(曲妥珠单抗)和化学疗法联合使用可以使74.4%的新诊断出的HER2阳性胃或胃食管交界性癌症患者的肿瘤缩小。这远远超过了标准的赫赛汀+化疗方案的51.9%。
5月初,默沙东Keytruda联合罗氏赫赛汀(曲妥珠单抗)和化学疗法的三联疗法获得FDA批准,用于治疗HER2阳性胃或胃食管交界处腺癌(GEJ)的新患者。该批准作为本来已经适应症繁多PD-1/L1类药物的一项,似乎并没有引起太大关注。但是FDA批准Keytruda该适应症的试验数据,或许将会引发另一类药物——免疫刺激剂类药物临床试验设计的新思考。
“K”药和“O”药决战胃癌领域
默沙东的Keytruda在胃癌适应症方面的开发往绩不佳,曾经在新诊断和先前接受过治疗的患者中两项关键性试验中遭遇过失败。5月5日,该药物获得FDA对部分胃癌患者(HER2阳性)的加速批准挽回了Keytruda在该领域的声誉。
Keytruda与罗氏的抗HER2主要药物赫赛汀和化学疗法联合使用,已经获得了FDA的批准,用于治疗HER2阳性的胃或胃食管交界腺癌的新患者。
业界有分析师表示,Keytruda提前批准是“积极的惊喜事件”,因为该批准是基于Keytruda中期肿瘤反应数据。这一批准使Keytruda保留在胃癌市场上,而且对PD-1/L1抑制剂制造商而言变得越来越重要。
在美国,每年约有10000名新诊断的胃/胃食管交界腺癌患者得到治疗,其中约四分之一是HER2阳性,这意味着3亿美元的市场机会。
FDA的决定基于Ⅲ期Keynote-811试验的中期数据。
KEYNOTE-811是一项多中心,随机,双盲,安慰剂对照试验,招募692例以前接受过全身治疗的HER2阳性晚期胃癌或胃食管交界腺癌的患者。通过PD‑L1表达(联合阳性评分[CPS]≥1或CPS<1),化疗方案(5-氟尿嘧啶[5-FU]加顺铂[FP方案]或卡培他滨加奥沙利铂[CAPOX方案])和地理区域(欧洲/以色列/北美/澳大利亚,亚洲或世界其他地区)随机进行分组。患者被随机分配(1:1)接受Keytruda/曲妥珠单抗/化学疗法,或安慰剂/曲妥珠单抗/化学疗法。
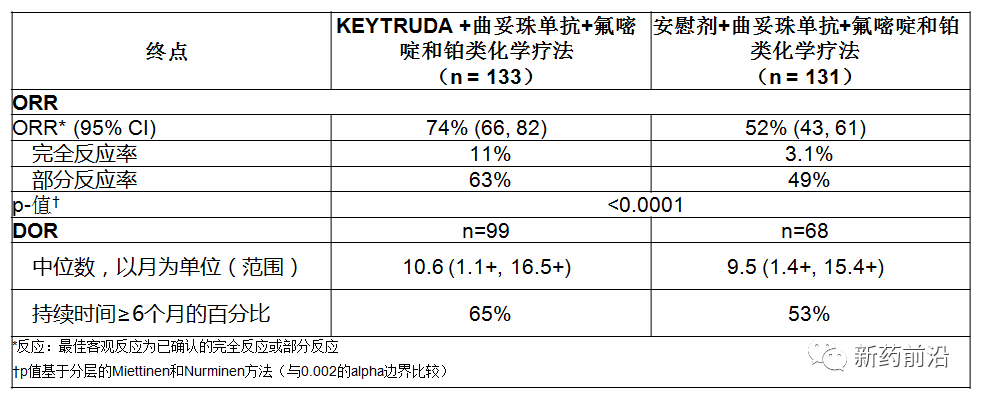
在进行中期分析时,对前264名随机分组的患者进行了客观反应率(ORR)和缓解持续时间(DOR)评估。结果显示,Keytruda/曲妥珠单抗/化学疗法组患者的客观反应率为74%,而接受安慰剂/曲妥珠单抗/化学疗法的患者为52%。对于接受Keytruda/曲妥珠单抗/化学疗法治疗的患者,完全缓解率为11%,部分缓解率为63%。对于仅接受安慰剂/曲妥珠单抗/化学疗法的患者,完全缓解率为3.1%,部分缓解率为49%。
在较早的Keynote-062试验中,Keytruda和化学疗法在延长PD-L1阳性,HER2阴性疾病的一线患者的生命方面未能超过单独的化学疗法。业界分析人士建议,失败的原因可能是该试验的统计设计引起的。
Keytruda单一药物在Keynote-061研究中作为二线治疗曾遭遇失败。这两次失败促使FDA外部专家小组在4月底以6比2投票赞成该机构取消对Keytruda用于三线胃或胃食管交界处腺癌的加速批准。
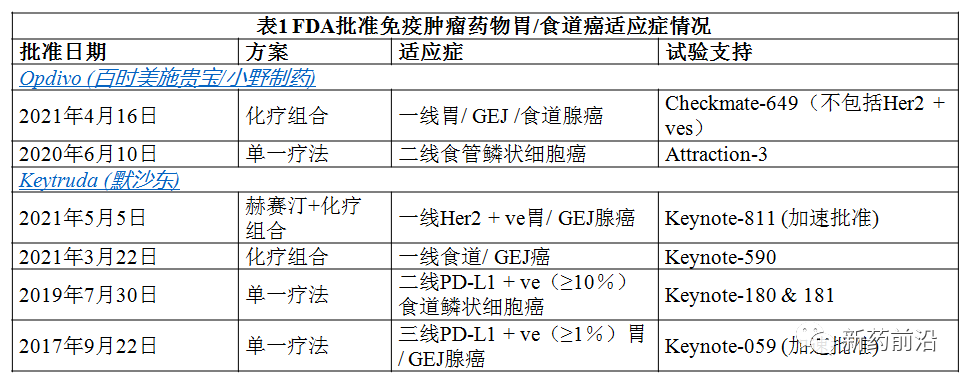
Keytruda新适应症的批准使其具有与百时美施贵宝Opdivo竞争的资本,今年4月,FDA批准Opdivo联合氟嘧啶和铂类化疗药物,用于一线治疗晚期或转移性胃癌(GC)、胃食管交界(GEJ)癌、食管腺癌(EAC)成人患者,无论PD-L1表达状态如何。值得一提的是,Opdivo成为了第一种获准用于以前未经治疗的胃癌的免疫肿瘤治疗剂。
然而,Opdivo新适应症批准是基于Ⅲ期CheckMate-649试验的生命延长数据,该试验将Opdivo与化学疗法联合,并排除了患有HER2阳性肿瘤的患者。
临床试验设计的启示
尽管以前在Her2靶向药物中添加PD-1/L1抑制剂并没有取得太大的成功,但是这次研究中,Keytruda/曲妥珠单抗/化学疗法无疑是取得了出乎意料的积极结果。
该结果不仅与默沙东和百时美施贵宝等PD-1/L1抑制剂开发者有关,而且对目前正在进行Her2抑制与免疫系统刺激联合测试的其他几家公司同样具有重要意义,包括CD3增强T细胞接合剂,以及更新一代的免疫刺激抗体偶联物(ISAC)。甚至可能会影响包括Pieris和Silverback在内的生物技术公司的药物开发战略。
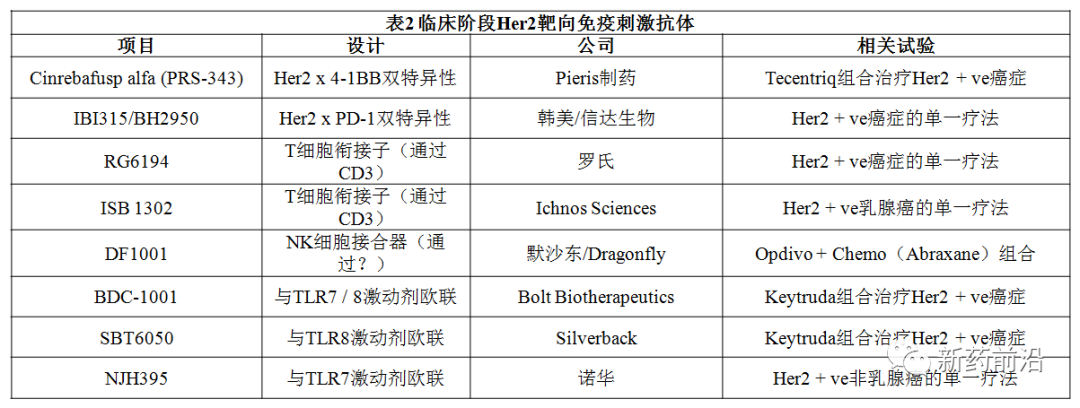
近来,Pieris制药公司开发的抗Her2/4-1BB双特异性抗体PRS-343(cinrebafusp alfa)陷入困境。在2020年的一半时间里处于部分临床搁置状态,其先前Ⅰ期研究在Her2阳性肿瘤中仅获得了13%的缓解率。今年4月中旬召开的2021年美国癌症研究协会年会(AACR)第一阶段会议上,对42位受试者评估中,报告的客观反应率同样低至12%,即5例患者,其中1例为完全缓解。更糟糕的是:3例缓解患者(包括完全缓解者)已经发生了肿瘤复发。Pieris强调了PRS-343在免疫原性低和Her2低表达的肿瘤中具有活性的初步证据,但该项目想与同类药物Enhertu竞争的最佳机会似乎将只能作为联合疗法的一部分。Enhertu(fam-trastuzumab deruxtecan)是由阿斯利康/第一三共共同开发,也是FDA批准的首款治疗HER2阳性转移性胃癌的靶向HER2的抗体偶联药物(ADC)。
PRS-343与Tecentriq进行单独的Ⅰ期试验,而将PRS-343与礼来的Cyramza或Seagen公司的Tukysa联合使用的Ⅱ期试验将在夏天开始。
信达生物的抗PD-1/HER2双特异性抗体IBI315;以及来自Bolt Therapeutics,Silverback和诺华独立开发的3款ADC,都使用TLR7和/或TLR8激动剂来刺激免疫系统。
Keynote-811试验结果显示的是,Her2拮抗作用和免疫系统激活联合可能在临床试验中取得成功的机会更高,但至关重要的是,也许还必须与化学疗法相结合形成三联疗法。
ISAC领域的某些项目正处于非常早期的单一疗法开发阶段,而其他项目正在与抗PD-1/L1抗体联合研究。但是,只有一项试验-Dragonfly/默沙东合作开发的DF1001也将化学疗法Abraxane(白蛋白结合型紫杉醇)纳入进来。
对于免疫刺激剂以及ISAC开发者来说,在临床试验设计中,添加化学疗法或许是成功的秘密武器。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..