中国国家药监局(NMPA)药品注册进度查询结果显示,罗氏(Roche)提交的流感创新药玛巴洛沙韦片(baloxavir marboxil,英文商品名:Xofluza)办理状态已更新为:在审批,这意味着该药有望近期在中国获批。公开资料显示,玛巴洛沙韦片本次申请的适应症为:用于12周岁及以上的流感患者,包括存在流感并发症高风险的患者。
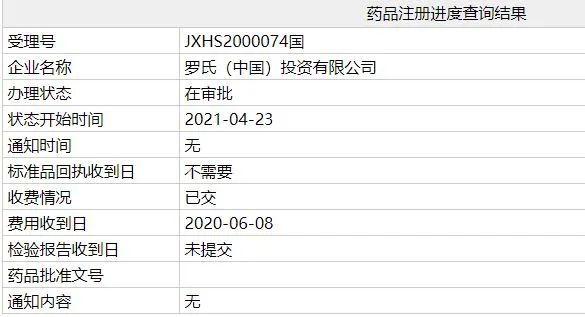
截图来源:NMPA官网
Xofluza是由日本盐野义制药公司(Shionogi)和罗氏合作研发的一款“first-in-class”的单剂量口服药物。该药物能够对奥司他韦产生抗性的病毒株和禽流感病毒株(H7N9,H5N1)起作用。与其它抗流感药物皆通过靶向神经氨酸酶来防止病毒传播的作用机制不同,Xofluza是通过抑制流感病毒中的cap-依赖型核酸内切酶,来起到抑制病毒复制的作用。
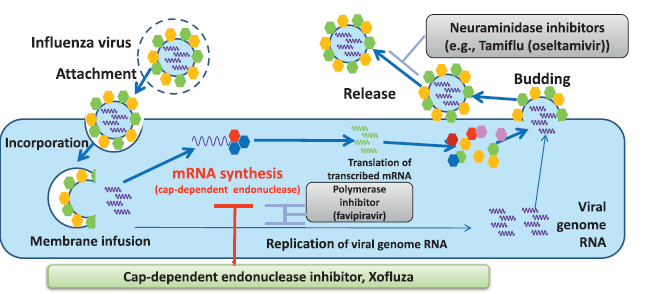
▲Xofluza的作用机理(图片来源:Shionogi官方网站)
2018年10月,Xofluza获得FDA批准上市,用于治疗12岁以上无并发症的急性流感患者,成为了近20年以来FDA批准的第一款具有创新作用机制的抗流感新药。2019年10月,FDA再次批准Xofluza的扩大适应症申请,用于治疗12岁及以上流感并发症高风险人群。2020年11月,Xofluza又获得FDA批准用于12岁及以上人群在接触流感患者后的流感预防(称为“暴露后预防”),新闻稿指出这是首个获批用于暴露后预防的单剂量流感药物。
在中国,Xofluza的上市申请于2020年6月获得CDE受理,并被纳入优先审评。2020年11月,该药已被纳入了第三批临床急需境外新药名单。根据优先审评公示信息,Xofluza本次在中国申请的适应症为——用于12周岁及以上的流感患者,包括存在流感并发症高风险的患者。
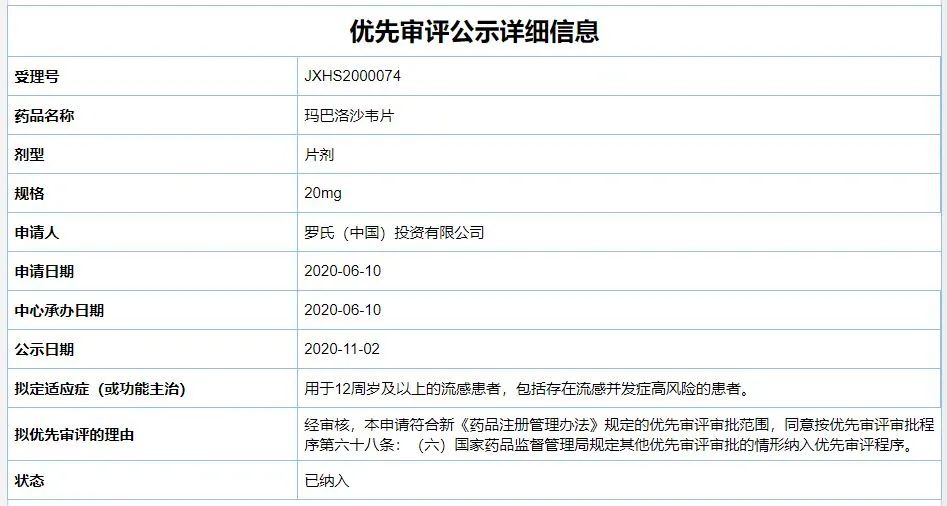
图片来源:CDE官网
根据Xofluza在美国获批时公布的临床数据,针对12岁及以上流感并发症高风险人群,该药具有良好的疗效和安全性。3期试验CAPSTONE-2研究结果表明:
在流感并发症高风险患者中,Xofluza显著延缓了流感症状出现的中位时间(102小时 VS 73小时);
与奥司他韦相比,Xofluza对流感症状的持续时间具有类似的疗效(54小时 VS 54小时);
对于B型病毒,与安慰剂相比,Xofluza能在更短的时间内改善流感症状(75小时VS 101小时);
此外,Xofluza还展示了良好的耐受性和安全性。
流感是全球人类健康的一个严重的威胁。流感有可能引起各种并发症,从鼻窦或耳部感染到更严重的并发症,例如肺炎。在流感患者患病48小时内,使用抗病毒药物可以降低疾病的症状和持续时间。本次,Xofluza在中国进入「在审批」意味着,该药将有望很快获批,惠及患者。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料
[1]中国国家药监局. Retrieved April 25,2021, from https://www.nmpa.gov.cn/zwfw/zwfwpjfbzs/pjfbzsyp/yppjfbzs/index.html
[2] Genentech Announces FDA Approval of Xofluza (Baloxavir Marboxil) for People at High Risk of Developing Influenza-Related Complications. Retrieved Oct. 17, 2019, from https://www.businesswire.com/news/home/20191017005525/en/Genentech-Announces-FDA-Approval-Xofluza-Baloxavir-Marboxil
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..