诺华(Novartis)公司今天宣布,美国FDA已授予其新一代IgE抗体疗法ligelizumab(QGE031)突破性疗法认定,用于治疗抗组胺疗法应答不足的慢性自发性荨麻疹(CSU)患者。
CSU是一种难于预测的重度皮肤疾病,影响0.5-1%的全球人群。其特征为出现瘙痒、疼痛性荨麻疹、或/和肿胀,持续至少6周,且发生原因未知。由于CSU的严重程度和不可预测的性质,对患者的生活质量造成严重影响。
Ligelizumab(QGE031)是新一代单克隆抗免疫球蛋白E(IgE)抗体。Ligelizumab被认为通过阻断IgE/FcεRI通路起作用,该通路是CSU中炎症过程的关键驱动因子。
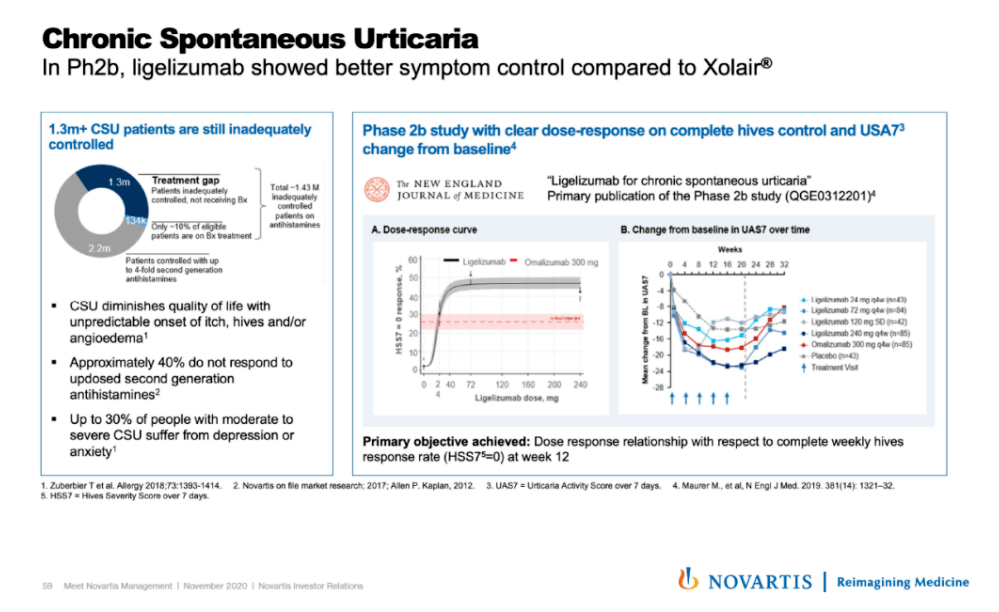
▲Ligelizumab的一项2b期临床试验结果(图片来源:诺华官网)
在一项2b期剂量探索试验中, 与上一代IgE抗体omalizumab相比,更多的患者使用ligelizumab后症状完全消退。在一项针对抗组胺药控制不佳的CSU患者的2b期剂量探索试验中,与omalizumab或安慰剂相比,未发现ligelizumab的安全性问题。目前正在进行的 3期临床试验项目已在全球48个国家招募了超过2000例患者, 预期在2021年下半年获得结果。
除了ligelizumab以外,诺华还在2期临床试验中检验布鲁顿氏酪氨酸激酶(BTK)抑制剂remibrutinib(LOU064)治疗慢性自发性荨麻疹的效果。
“慢性自发性荨麻疹可能显著影响患者的生活。由于可用的治疗选择非常少,患者正在寻找更多更好的疗法来控制他们的病情。”诺华肝脏、皮肤病、和免疫学部全球开发负责人Angelika Jahreis博士说,“FDA的突破性疗法认定显示了解决这些患者未满足医疗需求的急迫性。”
注:本文旨在介绍医药健康研究,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1] Novartis ligelizumab (QGE031) receives FDA Breakthrough Therapy designation for patients with chronic spontaneous urticaria (CSU). Retrieved January 14, 2021, from https://www.novartis.com/news/media-releases/novartis-ligelizumab-qge031-receives-fda-breakthrough-therapy-designation-patients-chronic-spontaneous-urticaria-csu
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..