▎药明康德内容团队报道
根据中国国家药品监督管理局(NMPA)药品审评中心(CDE)网站公示信息,截止9月30日,2020年第三季度共计有44项(按受理号统计)上市申请被正式纳入优先审评, 涉及25款新药和3款仿制药,来自百济神州、罗氏 (Roche)、恒瑞医药等20多家公司 (点击文末“ 阅读原文”可下载完整名单)。其中,有 15款药物以“符合附条件批准”被纳入优先审评。
从药品类型来看,这些药物既包括 PD-1/L1抗体、抗体偶联药物(ADC)、CAR-T疗法等免疫疗法,也包括靶向MET、RET、PARP等的小分子抗癌药。此外,还有多款“临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”被纳入,涵盖乙肝、艾滋病,心衰等疾病领域。

图片来源:123RF
(一) “符合附条件批准的药品”占15款, 14款 为抗肿瘤药
附条件批准上市的药品包括用于治疗严重危及生命且尚无有效治疗手段的疾病以及罕见病的药品,和公共卫生方面急需的药品。今年7月8日,NMPA发布《药品附条件批准上市申请审评审批工作程序(试行)》,附条件批准相关政策正式在中国开始实施。
今年第三季度, 共计有15款产品被纳入优先审评,且所有产品均为创新候选药。值得一提的是,这些产品中除了恒瑞医药的海曲泊帕乙醇胺片,拟开发用于对免疫抑制治疗疗效不佳的重型再生障碍性贫血患者的治疗。 其余14款产品拟定适应症均为抗肿瘤领域,覆盖非小细胞肺癌、胃癌、乳腺癌、特定急性髓系白血病、外周T细胞淋巴瘤等癌种。
这些产品中, 有抗体偶联药物、CAR-T疗法等前沿创新疗法,如荣昌生物核心候选药物靶向HER2的ADC疗法RC48,药明巨诺靶向CD19的CAR-T治疗产品瑞基仑赛注射液。 也有精准靶向的小分子抑制剂,如基石药业的RET抑制剂普拉替尼与KIT和PDGFRA突变激酶抑制剂阿泊替尼,和黄医药强效且高选择性MET抑制剂沃利替尼,百济神州在研PARP1和PARP2抑制剂帕米帕利,再鼎医药酪氨酸激酶开关控制抑制剂ripretinib等。
值得一提的是,这些附条件批准上市的产品中, 有多款PD-1/L1抗体,其中罗氏的阿替利珠单抗,恒瑞医药的卡瑞利珠单抗,默沙东(MSD)的帕博利珠单抗,以及君实生物的特瑞普利单抗此前均已在中国获批上市。这表明, 拓展PD-1/L1抗体的新适应症已成为这些企业的一个研发重点。
(二)多款抗感染药被纳入,针对乙肝、艾滋病等疾病
在第三季度中, 有六款“临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”被纳入优先审评(详见下表)。例如,用于治疗慢性心力衰竭成人患者的“first-in-class"新药vericiguat,用于狂犬病毒暴露患者被动免疫的重组人源抗狂犬病毒单抗,用于嗜酸性肉芽肿性多血管炎的美泊利单抗等。

其中, 来自艾迪药业的ACC007片和真实生物的阿兹夫定片,拟定适应症均为治疗HIV感染患者。当下,由HIV病毒感染引起的艾滋病,仍然是威胁人类健康的重大传染病。目前的联合抗逆转录病毒疗法虽然可显著提高患者的生活质量和延缓疾病进展,但存在终生服药,毒副作用、依从性差和耐药等一系列问题。临床上,患者仍然需要更好的新药来改善病情。
值得一提的是,该季度还有 豪森药业的1类新药艾美酚胺替诺福韦片被纳入优先审评,拟用于慢性乙型肝炎成人患者的治疗。乙型肝炎病毒(HBV)是世界上最常见的严重肝脏感染,是导致肝癌的首要原因,每年导致超过80万患者的死亡。这款来自豪森药业的新药是一种核苷逆转录酶抑制剂,为新一代单磷酰胺单酯类的替诺福韦前药。它在血浆中非常稳定,因此有望为慢性乙肝患者提供一种既能提高疗效,又能降低毒性与副作用的创新疗法。
(三)3款仿制药入选,来自恩华药业、 健进制药 等公司
在今年第三季度中,还有 3款来仿制药被纳入优先审评。来自 恩华药业、 爱美津制药、 健进制药。
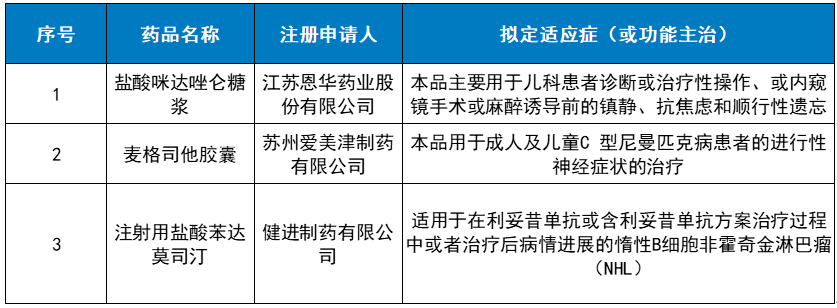
其中, 来自恩华药业的盐酸咪达唑仑糖浆, 以“符合儿童生理特征的儿童用药品新品种、剂型、规格”纳入优先审评。根据CDE公示,该产品主要用于儿科患者诊断或治疗性操作、或内窥镜手术或麻醉诱导前的镇静、抗焦虑和顺行性遗忘。由于儿童的特殊性,这类人群的镇静麻醉在临床实践中常面临一些挑战。
另一款是 来自爱美津制药的麦格司他胶囊,适应症是针对一种罕见的、进行性的并且最终致死的神经退行性疾病——C型尼曼匹克病。麦格司他是一种葡糖神经酰胺合成酶抑制剂,它能够降低葡萄糖脑苷脂水平,从而缓解患者症状。来自Actelion公司的原研产品泽维可已于2015年在中国获得有条件批准上市。除了上述2款产品,目前尚未有其他公司在中国申报麦格司他的临床试验或上市申请。
该季度还有 健进制药的注射用盐酸苯达莫司汀,以“同一生产线生产,已于2020年在美国上市,申请国内上市的仿制药”纳入优先审评。这是一种含有类嘌呤苯并咪唑环的双功能氮芥衍生物,可以导致DNA单链和双链通过双烷化交联。此前,该产品在美国已被批准用于治疗慢性淋巴细胞性白血病(CLL)和惰性B细胞非霍奇金淋巴瘤(NHL)患者。
其它
此外,今年第三季度纳入优先审评的产品还有石药集团自主开发的2类新药盐酸米托蒽醌脂质体,安斯泰来(Astellas)下一代FLT3酪氨酸激酶抑制剂(TKI)吉瑞替尼,赛诺菲(Sanofi)IL-4和IL-13“双靶点”抗体度普利尤单抗等。限于文章篇幅,本文不再一一点评(点击文末“阅读原文”可下载完整名单)。
希望这些产品在优先审评审批政策下,加速获批上市,早日为患者带来创新疗法。
拓展阅读:
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。
医药观澜”微信公众号,了解更多中国医药创新动态。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1]中国国家药监局药品审评中心(CDE).Retrieved Oct 21,2020, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=21#
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..