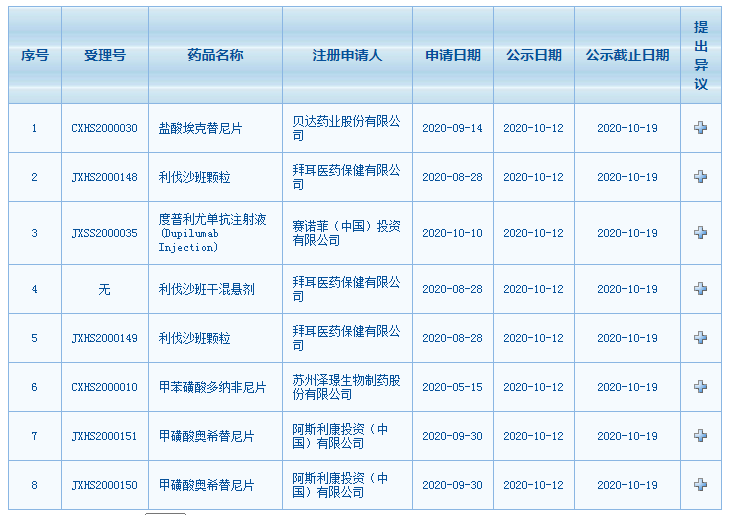
近日,据CDE官网数据显示,又有多款药品拟纳入优先审评,包括贝达药业的盐酸埃克替尼,拜耳的利伐沙班,赛诺菲的度普利尤单抗,阿斯利康的奥希替尼以及泽璟制药的甲苯磺酸多纳非尼。
其中泽璟制药的甲苯磺酸多纳非尼为新药上市申请,其他均为新适应症申报。
泽璟制药:甲苯磺酸多纳非尼片
甲苯磺酸多纳非尼片是泽璟制药开发的口服多靶点、多激酶抑制剂类小分子抗肿瘤药物,属于 1 类新药,公司拥有独立的自主知识产权。
此前,多纳非尼已被中国临床肿瘤学会(CSCO)发布的2020年版《原发性肝癌诊疗指南》列为晚期肝细胞癌一线治疗药物,并且是I级专家推荐和1A类证据。
此次多纳非尼上市申请拟纳入优先审评,拟开发用于治疗晚期(无法手术或转移性)肝细胞癌。根据一项名为ZGDH3的多中心2/3期临床研究,在未接受过系统治疗的不可手术或转移性晚期肝细胞癌患者中,多纳非尼治疗组的中位总生存期(mOS)显着优于对照组。
贝达药业:盐酸埃克替尼片
此次贝达药业的盐酸埃克替尼(商品名:凯美纳®)为第三个适应症上市申请拟纳入优先审评审批,单药适用于 II-IIIA 期伴有表皮生长因子受体(EGFR)基因敏感突变非小细胞肺癌(NSCLC)术后辅助治疗。
埃克替尼是贝达药业自主研发的国内第一个拥有自主知识产权的小分子靶向抗癌药,属于1类创新药。
其疗效确切、肝毒性低、安全性高,循证医学临床证据丰富,中国人群数据全,在 CSCO 指南、卫健委诊疗规范及脑转移人群、21-L858R NSCLC 患者中获优先推荐,也是目前唯一继续开展后续免费用药项目的一代 EGFR-TKI 原研药,具有明显的差异化优势。
目前,埃克替尼已获批两项适应症:
单药适用于治疗表皮生长因子受体(EGFR)基因具有敏感突变的局部晚期或转移性非小细胞肺癌患者的一线治疗;
单药可试用于治疗既往接受过至少一个化疗方案失败后的局部晚期或转移性非小细胞肺癌,既往化疗主要是指以铂类为基础的联合化疗。
据Insight 数据库显示,贝达于 9 月 23 日提交该新适应症上市申请。此次上市许可申请依据的是 EVIDENCE 研究,该项研究是针对Ⅱ-IIIA 期肺癌 EGFR 突变患者术后辅助治疗的对照试验,试验组为埃克替尼治疗,对照组为标准辅助化疗。该项目历时近 6 年,研究结果显示埃克替尼的疗效优于标准辅助化疗,能显著延长患者无病生存期,同时安全性更优。
阿斯利康:甲磺酸奥希替尼片
奥希替尼(泰瑞沙,AZD9291)是阿斯利康开发的一种不可逆、第三代EGFR-TKI,可同时抑制EGFR敏感突变和EGFR-T790M耐药突变,并对中枢神经系统转移病灶有临床疗效。
目前在中国,该产品已获批用于EGFR突变阳性的晚期NSCLC患者的一线治疗,以及EGFR-T790M突变阳性的晚期NSCLC患者的二线治疗。并且,它还被纳入国家医保目录。
此次奥希替尼新适应症拟纳入优先审评,拟开发用于具有EGFR敏感突变的NSCLC成人患者肿瘤切除术后的辅助治疗。
值得一提的是,该适应症在美国已被FDA授予突破性疗法认定。这主要基于奥希替尼3期临床试验ADAURA的优异结果,在这项试验中,奥希替尼使疾病复发或死亡风险降低约80%。
拜耳:利伐沙班颗粒/干混悬剂
利伐沙班(拜瑞妥)是拜耳一款口服,具有生物利用度的Xa因子抑制剂,其选择性地阻断Xa因子的活性位点,且不需要辅因子(例如抗凝血酶Ⅲ)以发挥活性。
在中国,该产品的片剂剂型已被批准用于预防和治疗成人静脉血栓(VTE),以及用于具有一种或多种危险因素如高血压的非瓣膜性房颤成年患者,以降低卒中和全身性栓塞的风险。
此次是利伐沙班颗粒剂和干混悬剂这两种剂型的上市申请在中国拟纳入优先审评,理由为符合儿童生理特征的儿童用药品新品种、剂型和规格。
根据CDE公示,新适应症为:用于足月新生儿、婴幼儿、儿童和18岁以下青少年患者开始标准抗凝治疗后的VTE的治疗及预防VTE的复发。
赛诺菲:度普利尤单抗注射液
赛诺菲的度普利尤单抗新适应症上市申请以符合儿童生理特征的儿童用药品新品种、剂型和规格的理由拟纳入优先审评,拟开发用于治疗外用处方药控制不佳或不建议使用外用处方药的12岁及以上青少年和成人中重度特应性皮炎。
今年6月19日,赛诺菲宣布,国家药监局已批准度普利尤单抗注射液(商品名:达比妥)用于治疗外用处方药控制不佳或不建议使用外用处方药的成人中重度特应性皮炎。
这也是全球首个也是唯一获批治疗成人中重度特应性皮炎的靶向生物制剂。2019年,达比妥被引进博鳌超级医院皮肤病临床医学中心,一位中重度特应性皮炎患者率先接受了首针注射。
2019年5月,达比妥被纳入CDE第二批临床急需境外新药名单,加速了上市审评过程,比原计划提前两年在中国获批。
达比妥是一款全人单克隆抗体,能够通过“双靶点”的创新作用机制,选择性的抑制关键信号通路白介素4(IL-4)和白介素13(IL-13),阻断2型炎症通路,降低2型炎症的病例反应,从机制上治疗2型炎症相关疾病。
达比妥具有良好的安全性和耐受性,能够在快速、显著、持续的缓解瘙痒、皮损等症状的同时,有效改善患者生存质量。今年2月《中国特应性皮炎治疗指南(2020)》发布,将尚未上市的达比妥列入推荐,以期待这一新药能填补目前药物无法满足的需求。
目前,达比妥已在包括美国、日本、欧盟约40个国家和地区获得监管机构批准并上市。根据一项全球协议,达比妥由赛诺菲和再生元公司联合开发。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..