今日,BridgeBio Pharma和其子公司Origin Biosciences宣布,美国FDA已经接受了为fosdenopterin(原名BBP-870/ORGN001)递交的新药申请(NDA)并授予其优先审评资格。Fosdenopterin是一种环吡喃单磷酸(cyclic pyranopterin monophosphate,cPMP)底物替代疗法,用于治疗A型钼辅因子缺乏症(MoCD)患者。新闻稿指出,这是BridgeBio公司首个被FDA接受的NDA。

A型MoCD是一种由于钼辅因子(MoCo)合成中断引起的常染色体隐性遗传,超极罕见的先天性代谢缺陷。MoCo对防止亚硫酸盐的神经毒性代谢物s-硫代半胱氨酸(s-sulfocystei)的积累至关重要。A型MoCD患者常为严重脑病和顽固性癫痫发作的婴儿。疾病进展迅速,婴儿死亡率高。那些存活超过最初几个月的患者出现大幅度发育迟缓,并遭受不可逆神经损伤。
Fosdenopterin是一款“first-in-class”cPMP氢溴酸盐二水合物,它可以替代cPMP并允许MoCo的合成步骤继续进行,在激活MoCo依赖性酶的同时消除亚硫酸盐。Fosdenopterin已经被FDA授予突破性疗法认定和罕见儿科疾病认定,如果获得批准,BridgeBio可能有资格获得优先审评券。
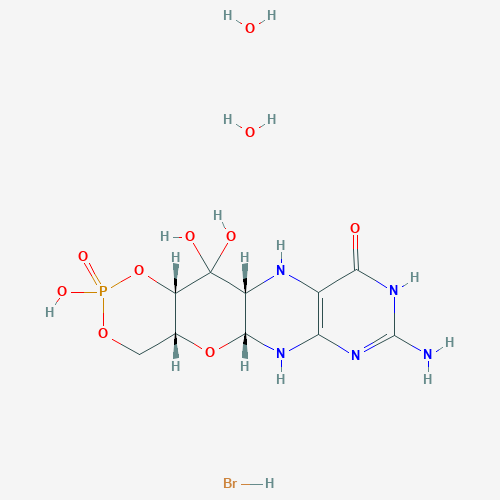
图片来源:PubChem
“我们要感谢帮助我们达到这一关键里程碑的患者、家属、科学家、医生和所有其他相关人员。”BridgeBio首席执行官兼创始人Neil Kumar博士说,“A型MoCD是一种灾难性疾病,中位生存期不到4年。我们渴望将这一疗法带给患者,他们目前尚无获批治疗选择。BridgeBio的存在是为了帮助尽可能多遭受遗传病折磨的患者,不管他们有多么罕见。”
注:本文旨在介绍医药健康研究,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1] BridgeBio Pharma and Affiliate Origin Biosciences Announces FDA Acceptance of its New Drug Application for Fosdenopterin for the Treatment of MoCD Type A. Retrieved September 29, 2020, from https://www.globenewswire.com/news-release/2020/09/29/2100490/0/en/BridgeBio-Pharma-and-Affiliate-Origin-Biosciences-Announces-FDA-Acceptance-of-its-New-Drug-Application-for-Fosdenopterin-for-the-Treatment-of-MoCD-Type-A.html
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..