8月28日,信达生物在药物临床试验登记与信息公示平台登记一项评价Pemigatinib对比吉西他滨联合顺铂一线治疗携带FGFR2重排的、手术不可切除或转移性胆管癌患者疗效和安全性的随机、开放、阳性药物对照、多中心III期临床研究。
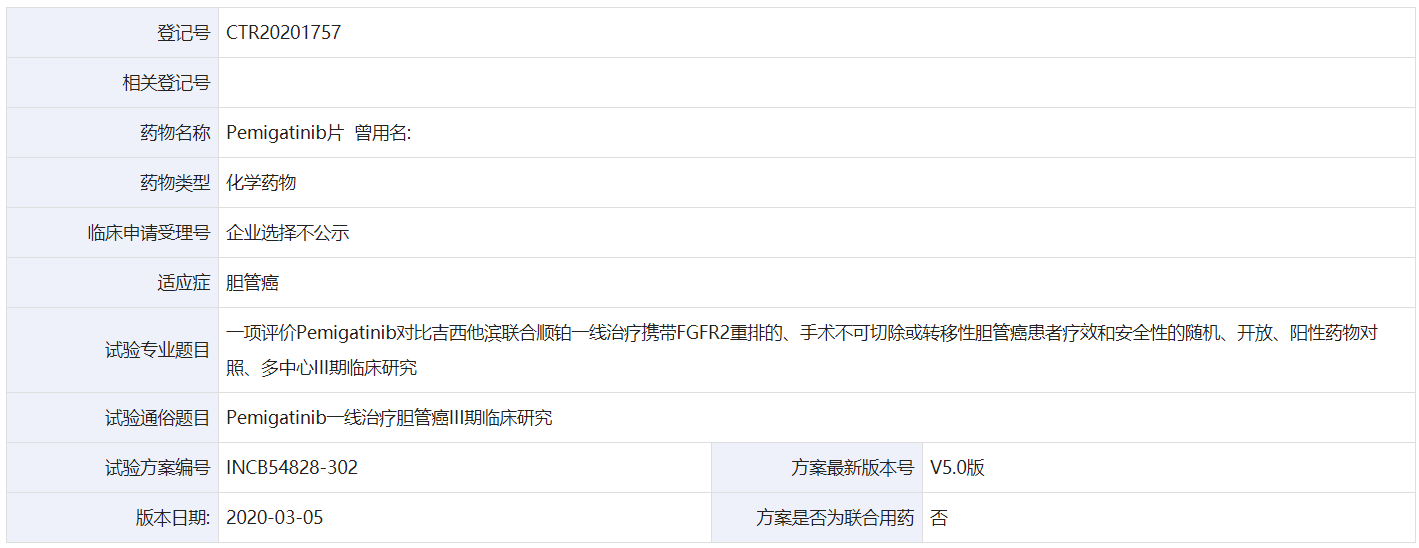
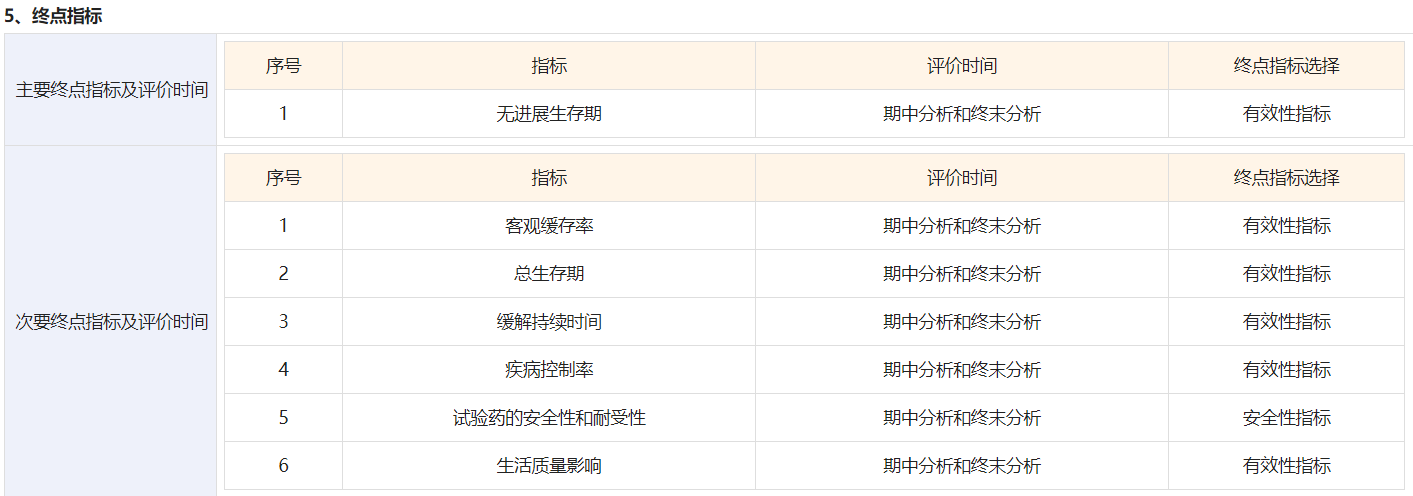
该研究预计在国内招募75例患者,研究目的是评价Pemigatinib对比吉西他滨+顺铂一线治疗携带FGFR2重排的胆管癌受试者的疗效。主要终点是无进展生存期,次要终点包括客观缓存率、总生存期和缓解持续时间等。
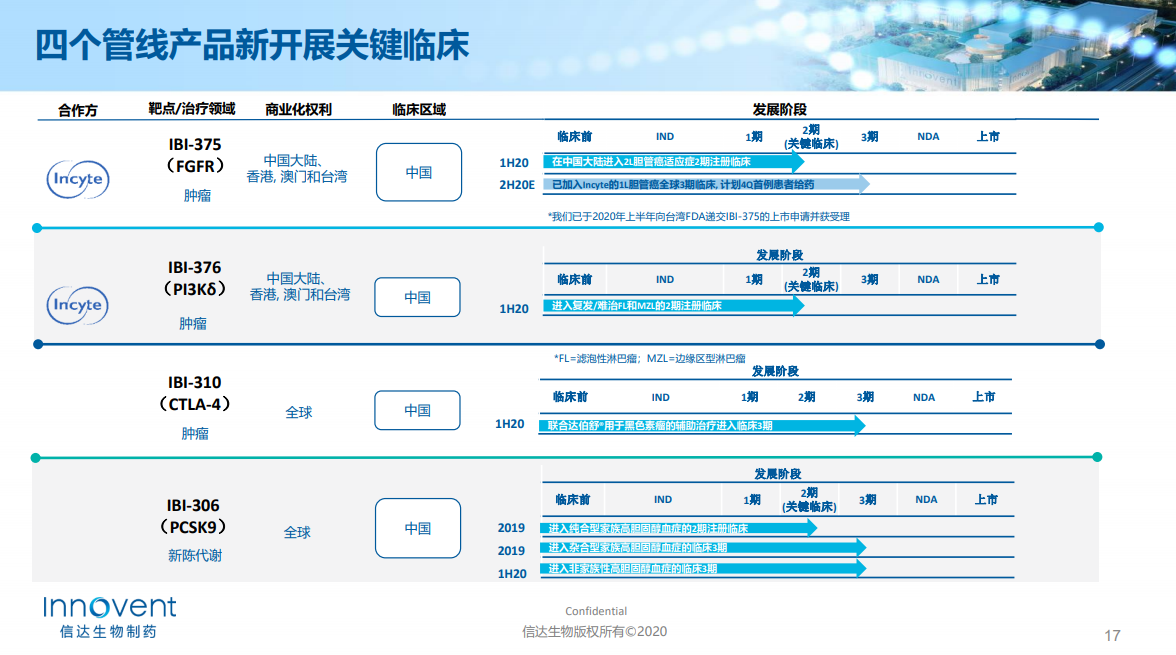
Pemigatinib是Incyte公司开发的一种针对FGFR亚型1/2/3的强效选择性口服抑制剂,目前已经获得FDA批准上市,适用于治疗既往经治的、采用一种FDA批准的检测方法检测到成纤维细胞生长因子受体2(FGFR2)基因融合或其他重排的、不可切除的局部晚期或转移性胆管癌成人患者。信达生物于2018年12月引进该药在中国大陆、中国香港、中国澳门和中国台湾地区的开发和商业化权利。信达生物中期业绩推介显示其已于2020年上半年向台湾FDA递交了该药的上市申请并获受理。
胆管癌是一种发生于胆管的罕见癌症。根据其解剖起源部位可以分为肝内胆管癌(iCCA)和肝外胆管癌。胆管癌患者通常在诊断时已处于疾病后期或晚期,预后较差。胆管癌的发病率存在区域性差异,北美和欧洲的发病率为0.3 ~ 3.4/100,000。FGFR2基因融合或重排几乎仅发生于iCCA,其中10% ~ 16%的患者存在这种情况。FGFR在肿瘤细胞增殖、存活、迁移和血管生成(新血管的形成)中发挥重要作用。FGFR的活化基因融合、重排、易位和基因扩增与多种癌症的发生密切相关。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..