根据中国国家药监局公示信息,罗氏(Roche)公司的两款在研乙肝新药获得批准在中国开展联合用药临床试验,分别是HBV核心蛋白质变构调节剂(CpAM,核心抑制剂)RO7049389 联合 toll样受体7(TLR7)激动剂 RO7020531 用于慢乙肝的临床试验。
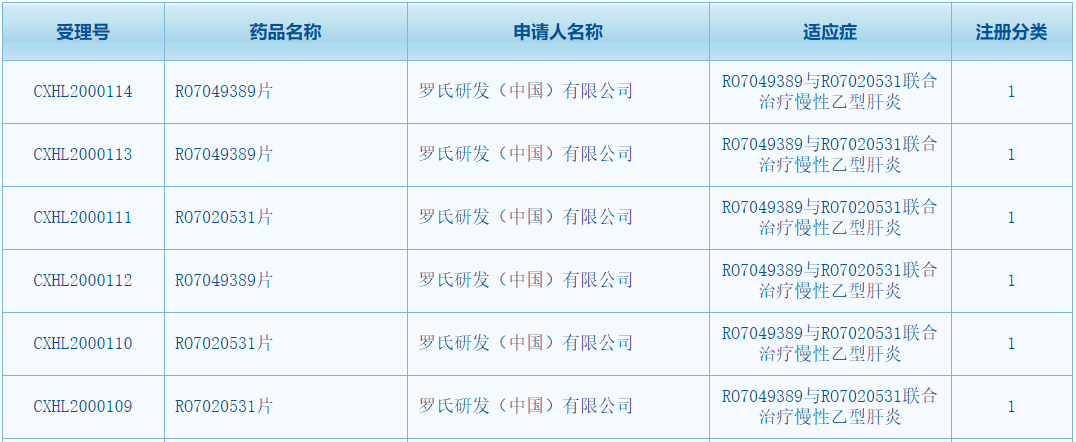
此前这两款药物均已获得在中国开展单药用药的临床试验并且部分研究均已完成。
RO7049389 是一种小分子I类HBV核心蛋白质变构调节剂(CpAM)。它可通过诱导异常乙型肝炎病毒(HBV)核心聚集体的形成,导致有缺陷的衣壳组装从而抑制HBV复制,并可能恢复宿主对 HBV 的免疫应答。
在体外基于细胞和体内动物模型的测定中,RO7049389 可有效抑制HBV复制。已公布的 Phase 1 期临床研究结果显示 RO7049389 在慢性HBV感染患者给药28天后表现出强大的抗HBV活性,且耐受性良好。
RO7020531是选择性 Toll样受体(TLR)7激动剂 RO7011785 的双前药。前期研究结果显示,RO7020531 在小鼠模型中主要刺激脾和淋巴结中的 I 型干扰素应答,但不在胃肠道(GI)道中。
在 AAV-HBV 小鼠模型中观察到 RO7020531 抗HBV作用呈现剂量依赖性方式,其中 TLR7 激动剂显著降低 HBV DNA 和 HBsAg 水平。在 AAV-HBV 模型中重现了由 RO7020531 引发的先天免疫反应,例如细胞因子和干扰素刺激基因(ISG)的上调。
在全球首次人体临床试验中,高达 170mg 的 RO7020531 单剂量和多剂量试验显示该药在健康志愿者和慢乙肝患者中均表现出良好的耐受性和安全性。
在 APASL2020 公布的在中国慢乙肝患者中进行的临床试验显示,RO7020531在中国健康受试者中单次给药至170 mg,多次给药至 150mg,每日1次,是安全和可接受的。
此次罗氏(Roche)公司的这两款在研乙肝新药在中国获批在中国慢乙肝患者中进行联合用药试验可谓是首次,因为据公开信息显示,在此之前中国从未有两款未上市新药获批在慢乙肝中开展联合用药临床试验,相信开了这个先河以后会有更多的在研乙肝新药联合用药临床试验在中国获批。这两款药物的联合用药临床试验中心目前暂未获知,希望已有相关信息的朋友可以在评论区中提供,在此先谢过(更多肝病新药研究信息敬请关注“肝脏时间”微信公众号)!
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..