▎药明康德内容团队编辑
根据美国约翰-霍普金斯大学(Johns Hopkins University)的统计,新冠病毒病(COVID-19)疫情的扩展已经导致全球患者超过100万人。与此同时,世界各地,针对COVID-19的研究活动也在迅速开展。世界卫生组织(WHO)总干事谭德塞博士在今天例行的新闻发布会上表示,已经有74个国家参与WHO协助进行的SOLIDARITY临床试验。超过200名患者已经入组。下面我们来看看今日COVID-19研发领域的其它进展。
FDA首次授予新冠病毒血清学检测紧急使用授权(EUA)
今日,FDA宣布,Cellex公司开发的qSARS-CoV-2 IgG/IgM快速检测在当地时间4月1日获得紧急使用授权(EUA)。这款检测用于定性检测血清、血浆、或静脉穿刺获得的血液中针对新冠病毒的IgM和IgG抗体。这一检测只限于在获得授权的CLIA实验室中使用。FDA同时表示,这一检测不能作为诊断的唯一标准。
这款检测是一种侧流免疫检测,与怀孕测试相似,如果样本中存在针对新冠病毒的IgM或IgG抗体,会在测试盒上M或G的位置出现有色线条。这一检测同时带有阳性对照线,如果这条线没有出现颜色,意味着检测结果无效,需要重新进行检测。
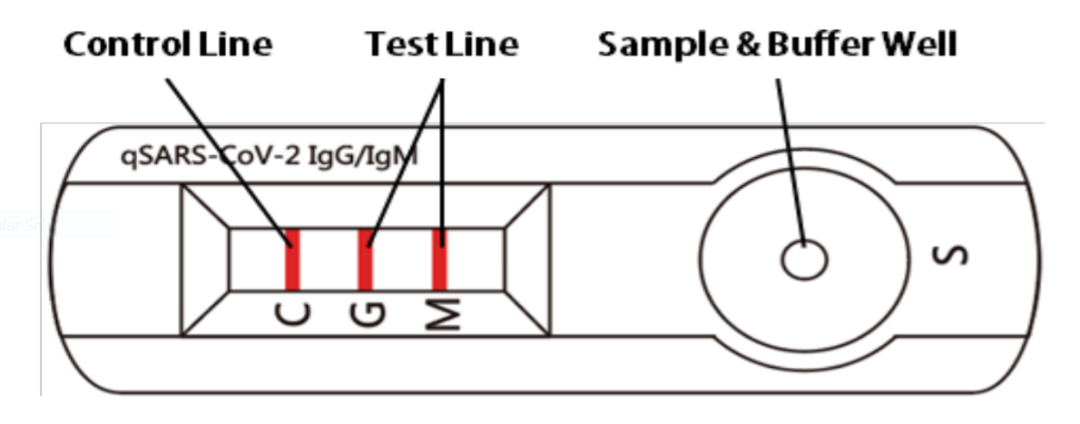
图片来源:参考资料[10]
此前,FDA虽然已经为20多种新冠病毒检测授予EUA,这些检测的原理都是检测患者样本中的病毒RNA。血清学检测采用的是另一种策略,它检测的是患者体内产生的针对病毒的抗体。FDA的EUA授权信中表示:“通常IgM抗体在病毒感染最初发生后几天内在血液中产生,然而抗体的水平与感染进程之间的关系尚未得到详细描述。针对新冠病毒的IgG抗体出现的时间要更晚一些。”
由于患者的免疫系统产生特异性抗体需要时间,这一检测在发现早期COVID-19患者方面可能缺乏灵敏度。然而,血清学检测可以用于发现曾经受到新冠病毒感染后康复的患者。这种检测的广泛使用对进行与COVID-19流行病学相关的研究具有重要意义。而且这项检测有可能发现已经对新冠病毒产生免疫能力的人群,从而为制定个体化社交隔离(social distancing)措施提供依据。
点击文末“阅读全文/Read more”,即可阅读FDA针对这一检测的EUA授权信。
近日,Bodysphere公司错误宣布FDA授予其血清学检测EUA。FDA在日前澄清并没有授予这一检测EUA。Bodysphere公司随后收回了获得FDA授权的新闻稿(详情请看药明康德今日报道)。
开发新冠病毒中和抗体,安进与Adaptive Biotechnologies达成合作
今日,安进(Amgen)和Adaptive Biotechnologies公司联合宣布,将结合双方各自的专长,联合开发靶向新冠病毒的全人源化中和抗体,用于治疗或预防COVID-19。
图片来源:Adaptive Biotechnologies公司官网
Adaptive公司的高通量技术平台,能够利用下一代测序技术(NGS),快速分析编码B淋巴细胞受体的基因组序列,这将帮助发现上千种COVID-19患者中已经存在的潜在中和抗体。安进公司将利用其抗体工程化专长和药物开发能力,选择、开发和制造能够与新冠病毒结合的中和抗体。
针对ACE2等靶点,Vir和Alnylam扩展研发合作
今日,Vir Biotechnology和Alnylam Pharmaceuticals联合宣布扩展双方的合作,开发针对传染病(包括COVID-19)的RNAi疗法。这一扩展合作将聚焦于人体中与新冠病毒感染相关的3个靶点,其中包括ACE2和TMPRSS2。这两个蛋白被认为在病毒侵入细胞的过程中起到关键性作用。Vir公司在功能性基因组学方面的研究可能提供第三个靶点。
RNAi是一种沉默基因表达的天然细胞机制,发现这一机制的研究获得了2006年的诺贝尔生理学或医学奖。通过利用细胞的这一天然机制,人工设计的siRNA能够与特定RNA序列结合并导致它们的降解,终止造成疾病的蛋白的表达。
根据协议,双方将使用Alnylam的创新siRNA偶联技术。这一技术让RNAi疗法能够被特异性递送到肺部。Alnylam的研究团队已经设计并合成了超过350个siRNAs,它们靶向新冠病毒基因组保守部分。最近Alnylam的科学家已经发现了主打候选siRNAs,它们在接受Vir的科学家们的进一步评估,检验这些候选siRNAs的抗病毒活性。
“生物医药行业需要推动全方位的潜在治疗手段来对抗COVID-19大流行。除了直接靶向新冠病毒基因组以外,我们对靶向对病毒感染和复制起到关键作用的宿主靶点的潜力感到非常兴奋,”Alnylam公司首席执行官John Maraganore博士说:“在这一公共卫生需求紧急的时刻,我们将以最大的紧迫感加快并扩展与Vir的研发合作,早日开发出针对COVID-19的在研RNAi疗法。”
参考资料:
[1] Amgen And Adaptive Biotechnologies Announce Strategic Partnership To Develop A Therapeutic To Prevent Or Treat COVID-19. Retrieved April 2, 2020, from https://www.prnewswire.com/news-releases/amgen-and-adaptive-biotechnologies-announce-strategic-partnership-to-develop-a-therapeutic-to-prevent-or-treat-covid-19-301033905.html
[2] Medical Professionals Across Merck & Co., Inc., Pfizer Inc., and Eli Lilly and Company Activate to Support Health Systems, First Responders and Patients Amid COVID-19 Pandemic. Retrieved April 2, 2020, from https://www.businesswire.com/news/home/20200401005708/en/
[3] Vir and Alnylam Expand Collaboration to Advance Investigational RNAi Therapeutics Targeting Host Factors for the Treatment of COVID-19. Retrieved April 2, 2020, from https://www.businesswire.com/news/home/20200402005167/en
[4] The 'game changer' that wasn't: Company falsely claimed FDA authorization for coronavirus blood test. Retrieved April 2, 2020, from https://edition.cnn.com/2020/04/02/health/coronavirus-test-false-fda-authorization/index.html
[5] Charlton E. Lui, CEO of BODYSPHERE, issued the following clarification statement this morning. Retrieved April 2, 2020, from http://www.mybodysphere.com/newsroom.html
[6] BD to offer fingerstick antibody blood test for COVID-19. Retrieved April 2, 2020, from https://www.fiercebiotech.com/medtech/bd-to-offer-fingerstick-antibody-blood-test-for-covid-19
[7] FDA authorizes first coronavirus antibody test. Retrieved April 2, 2020, from https://www.cnn.com/2020/04/02/health/fda-coronavirus-antibody-test-authorization/index.html
[8] FDA. Retrieved April 2, 2020, from https://www.fda.gov/media/136622/download
[9] Cellex. Retrieved April 2, 2020, from http://cellex.us/
[10] Cellex qSARS-CoV-2 IgG/IgM Rapid Test. Retrieved April 2, 2020, from https://www.fda.gov/media/136625/download
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..