在应对公共卫生紧急状态中,如果要有效发挥医药对策产品的作用,责任保护必不可少。
2013年《大流行和全风险防范与再授权法案》(The Pandemic and All-Hazards Preparedness Reauthorization Act of 2013,PAHPRA法案),[1]加强对了已获批和未获批MCM产品的紧急使用权限。由于相关的责任保护,通常取决于所使用的MCM产品的适当授权。因此,PAHPRA法案中规定的权限,对于保护公共卫生利益攸关方的侵权责任保护(tort liability protection)至关重要。《大流行与全风险防范与推进创新法案》(Pandemic and All-Hazards Preparedness and Advancing Innovation Act,《PAHPAIA法案》,再次明确相关权限。[2]药品紧急使用权限的贯彻落实,相关的责任保护(liability protection),是不可或缺的条件。在EUA的具体实践和发展中,责任保护在促进对备灾、紧急状态响应和相关人员的保护方面,发挥着不可或缺的重要作用。[3]
依据《美国法典汇编》第42编第233节(42 USC § 233)以及第28编第2679节(28 USC § 2679)规定,卫生部与公众服务部部长或受其指定者,应视具体情况,为公共卫生署(Public Health Service)的所有人员或雇员,保证对其无害或提供责任保险(Public Health Service),以保障相关人员因疏忽而引致的伤害,包括死亡,或相关人员在办公室或工作范围内工作,并因履行医疗、外科、牙科或相关职能工作(包括开展临床研究或调查工作);以及如果相关员工被指派到国外或具体规定的国家或政治部门或其非营利机构,相应情况可排除(美国法典汇编)第28编第2679(b)节所述对美国的这种损害或损害的补救办法。[4,5]
2011年,疾病预防控制中心(CDC)确定,将15项能力作为公共卫生准备规划的国家标准。自那时以来,这些能力标准已成为各州、地方、部落和地区备灾方案的重要框架,用于规划、实施和评估其准备、应对和从公共卫生中紧急状态恢复的能力。[6] 2017年,升级这些能力项,重点是简化语言,使内容与新的国家标准,不断发展的科学研究结果,以及现行公共卫生优先事项和策略保持一致。这些能力还支持诸如对抗流感大流行、环境卫生、高危人群和部落人群等主题。
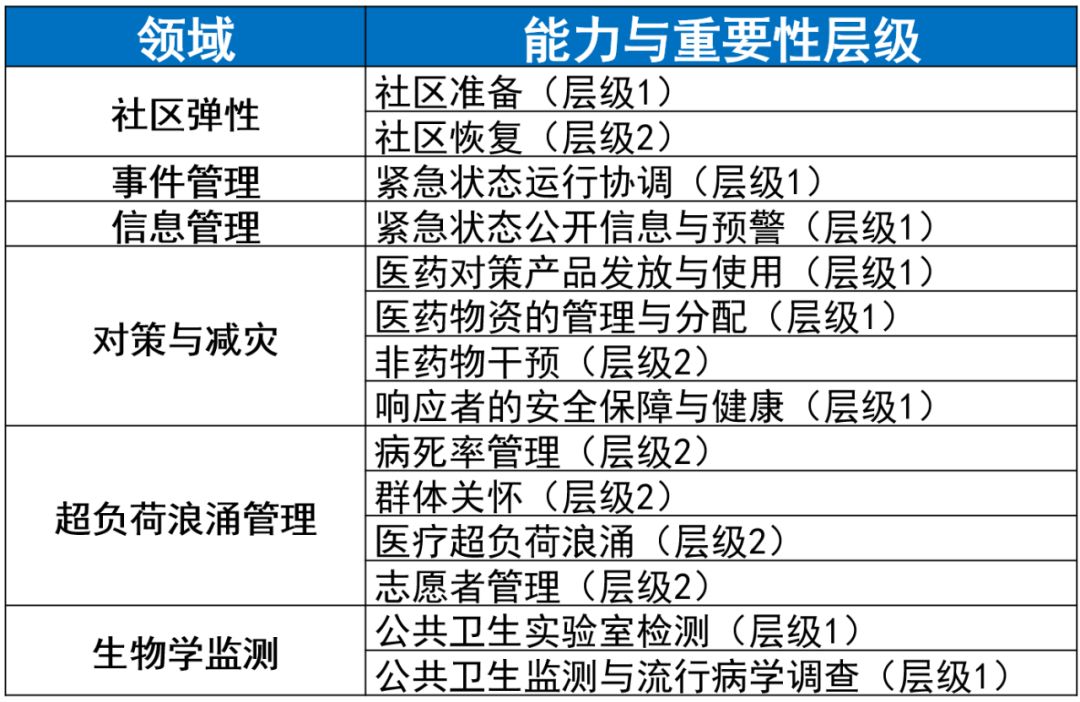
▲表1. CDC确定的应对公共卫生紧急状况的15项能力[6]
MCM产品(MCM产品)发放,属于一种核心的公共卫生准备能力。[6]在紧急状况下,采取大批量发放的方式,对于承担发放操作的机构与人员,法律保障不可或缺。有效地解决这些关切,作为对负责发放MCM产品或协助相关活动,例如为发放点(point of dispensing,POD)提供支持的人员进行培训的重要组成部分,可以帮助加强响应人员的准备程度,从而增强社区对新出现传染病紧急状态或化生放核剂紧急状态的准备。
尽管法律考虑因采用的发放方式与为支持相关进程动员的人员类别有所差异,但两个反复出现的问题,引起参与大批量发放的机构和个人的焦虑。这些法律问题,涉及到发放具体的MCM产品的权限和发放MCM产品的人员所承担的附带侵权责任(tort liability)。
MCM产品的紧急使用
除了传统的药品审评审批途径,新出现了几条其它的法律途径,有利于MCM产品的紧急使用。这几条途径包括,紧急使用授权(EUA)和在具体情况下,使用FDA批准的MCM产品,以及不同于正常情况下FDA对新药、简化新药申请、医疗器械的批准途径。有关紧急使用授权,以及在紧急状况下使用相关MCM产品的详细介绍,请参阅药明康德内容团队文章: 《美国FDA如何开展医药产品紧急使用授权?》 ;[7] 《没有医药产品紧急使用授权情况下,FDA如何开展医药产品紧急使用?》 ;[8]有关药品扩展使用的详细介绍,请参阅 《权威机构报告:FDA与医药商支持让临床亟需患者用上试验用药》 ;[9]有关MCM产品监管的文章,请参阅 《应对公共卫生紧急状态医药对策产品开发:FDA的实践与挑战》 。[10]
MCM产品开发面临挑战
上世纪80年代,人类面临的主要的新出现传染病是艾滋病。但进入90年代之后,至今已发生多起新出现传染病、复发传染病流行和大流行事件。
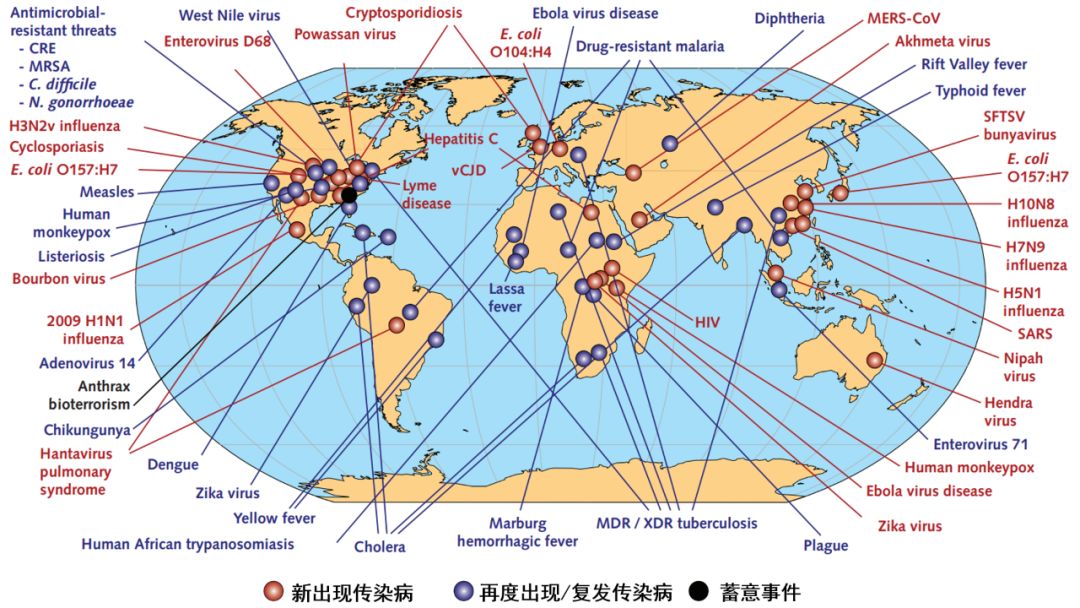
▲上世纪90年代以来,到新冠肺炎大流行发生之前出现的传染病流行情况(图片来源:参考资料[11])
面临新出现传染病威胁,由于对相关病原体了解有待深入,在紧急状况下开发MCM产品,与正常情况下的药品开发不同,生产和上市后环节,往往会面临更多地不确定性。如何保证MCM产品能够有效地投入使用,涉及到从研发、评价、制造、配送、发放、管理、使用等多个环节。

▲表2. 公共卫生紧急状态下,对相关的在研MCM产品评价,与正常情况下不同[12]
侵权责任考量
在展开问题之前,先介绍责任(liability)与侵权(tort)的法律概念。责任(liability),在法律上指根据法律或公正原则应履行的责任、义务,包括各种绝对的、偶然的,或将来可能承担并通过诉讼可以执行的责任、义务;也指实际或可能要承担责任的状态。侵权(tort)在法律上的通常含义,指侵犯法律规定而非合同约定的权利,并导致诉讼产生的不法行为或损害行为。在普通法上,侵权行为所侵害的,是被侵害人所追求的私人利益。侵权行为法,是由法院对法律上的不正当损害给以救济,而非可以适用于各种案件的一般责任原则。[13]
2005年发生卡特琳娜飓风灾难之后,2005年底,国会通过《公众使用意愿与紧急状态准备法案》(Public Readiness and Emergency Preparedness Act,《PREP法案》),通过对MCM产品开发与交付相关的一系列活动提供责任保护,助力MCM产品创新。[14] 2015年12月30日生效的《PREP法案》,对《公共卫生服务法案》(the Public Health Service,《PHS法案》)做出修订,新加入第319-F-3节,该节主要阐述了责任豁免;同时加入第319-F-4节,该节阐述了相关的赔偿方案。新增加的法定内容,编入《美国法典汇编》第42编第247d-6d和247d-6e节。[15,16]
除了解决MCM制造商与发放机构的责任关切,国会寻求通过立法,减轻在MCM产品发放、开具处方和管理方面对可能面临的法律风险的忧虑。[17] 相关的责任保护一旦被触发,依据《PREP法案》规定的责任保护,可以涵盖“MCM产品所涉及的所有参与者”。[18] 《PREP法案》特别赋予了卫生与公众服务部部长相关的权限,部长可以声明,对所有与管理或使用特定MCM产品引起特定健康问题的损失索赔,授权免于侵权责任。除了在极少数情况下因“蓄意不当行为”导致死亡或严重人身伤害的情况外,给予相关的豁免权,排除了依据联邦法律或州法律要求,对MCM产品接收者蒙受的损失寻求侵权赔偿的所有诉讼。[15]
与卫生与公众服务部部长职权范围内所涉及的其它类型的法令不同,例如公共卫生紧急声明或支持紧急授权的声明,《PREP法案声明》,专门针对优先MCM产品提供针对性的责任保护(liability protection)。[19] 依据《PREP法案》,为了发布《PREP法案声明》,卫生部部长必须确定疾病、病症、或公共卫生所面临的威胁构成了公共卫生紧急状态,或在未来构成此类紧急状态的具体风险。依据相关威胁的严重程度,卫生部部长发布的《PREP法案声明》,可能会推荐一个或多个MCM产品,具体说明所推荐的MCM产品所涉及的医疗问题类型、法律保护的有效期限,接受该产品的人数,对发放管理或使用的所有地理区域的限定(参见下表)。该声明可以进一步细化对分发方式的限制,以及属于其它类别的具备资质开具处方、管理或分发MCM产品的授权者,例如按照相关州的州法律,尚未获得适用的州法律授权的人员。[15] 《PREP法案》可以在突发公共卫生事件之前做出,并且可以为宣布突发公共卫生事件之前和之后的活动提供责任豁免。
《PREP法案声明》条目
2013年3月13日生效的《大流行与全风险防范再授权法案》(The Pandemic and All-Hazards Preparedness Reauthorization Act,PAHPRA法案,第113-5号公法)[1],除了其它事项之外,《PAHPRA法案》对《联邦食品、药品和化妆品法案》(FD&C法案)第564A和564B节做了补充,为在紧急状态下紧急使用已获批产品和储备用于紧急使用的相关产品提供新的授权。PAHPRA法案据此修订了《公共卫生服务法法案》(PHS法案)第319F-3节(PREP法条款)中的“所涵盖的医药对策”与“具备资质的用于大流行病与流行病的产品”的定义,因此,PREP法案声明涵盖了依据相关的FD&C法案授权供应的产品。[3]《PAHPRA法案》同时扩展了PREP法案声明中可能涵盖的具备资质的用于大流行和流行病产品的定义,纳入旨在增强针对大流行或流行病使用的药品、生物制品、器械的产品或技术,或者针对上述相关产品不良事件的产品或技术。

▲表3. 《PAHPRA法案声明》的内容与法律依据[23]
《PREP法案》所规定的责任保护,适用于“所涵盖的对策”所涉的“所涵盖的人员”。PREP法案声明具体定义所有术语,以界定其保护范围。“所涵盖的对策”,包括已获批产品;或被新药临床试验(IND申请)或器械临床试验(IDE)所涵盖的产品;获得紧急使用授权(EUA),或获得FDA批准并在2013年《大流行与全风险防范再授权法案》(Pandemic and All-Hazards Preparedness Reauthorization Act of 2013,《PAHPRA法案》)紧急使用权限下获准使用的紧急药物。[3] 对于所涵盖的MCM产品的管理和使用,"所涵盖人员"既可包括相关的州授权开具处方或发放的执业医护人员,也包括《PREP法案声明》本身指定的其他人群。[1]

▲表4. 目前生效的《PREP法案声明》[20]
以2020年应对新冠肺炎的《PREP法案声明》为例,[21] 2020年1月31日,依据《PHS法案》第319节,《美国法典汇编》第42编第247d节,卫生部部长Alex Azar宣布,自1月27日期,全美进入公共卫生紧急状态,要求全美医药卫生界对新冠病毒爆发做出响应。[22]
Azar部长在2月4日发布的《PREP法案声明》中表示,在考虑需要覆盖的MCM产品时,必须考虑是否需要鼓励设计、开发、临床检测或研究、制造、标签、分发、配方、包装、市场营销,促销、销售、采购、捐赠、发放、处方、管理、许可及MCM产品的使用等因素。[23]
依据《PREP法案》发表的声明规定的责任豁免活动
依据《PREP法案》责任豁免的相关条款,由卫生部部长做出的本次《PREP法案声明》所涵盖的活动包括所涵盖的MCM产品的制造、测试、开发、分发、管理、使用。[23]
Azar部长声明,依据《PREP法案》赋予的赔偿责任保护,对所建议的活动有效。相关的责任保护规定,“依据《PREP法案》的其它规定,所涵盖人员,对于个人因使用所发布声明阐述的MCMMCM产品的所引起合伙导致的所有损失索赔,均免受联邦和州法律的诉讼与责任诉讼(suit and liability)。”[23]
所涵盖人员[24]
依据《PREP法案》,将所涵盖的人员定义为,包括联邦政府以及制造、分发、管理、开具处方或使用所涵盖的MCM产品的人员。这次发布的《PREP法案声明》,包括依据PREP法案,即《PHS法案》第317F-3(i)(2)节)定义为“所涵盖人员”的所有人员和实体,以及第(3),(4),(6),(8)(A)和(8)(B)款中所涵盖的其他人员与实体。[3]
依据《PREP法案》规定,相关的责任豁免权(liability immunity)适用于关系到所涵盖的MCM产品管理与使用的“所涵盖人员”。这里的“所涵盖人员”一词具有特定含义,依据《PREP法案》中的相关定义,包括制造商、配送机构、计划策划人员、授权人及其官员、代理商、雇员和联邦政府。《PREP法案》还进一步定义了“制造商”、“配送机构”、“计划策划人”与“授权人”。[3]
制造商包括相关制造商的承包商或分包商;在所涵盖MCM产品的设计、开发、临床测试、研究或制造中使用的任何产品、知识产权、服务、研究工具或组件或其它物品的供应商或许可人;以及制造商的所有母公司、子公司、关联公司、继承人和受让人。
配送机构指从事药品、生物制剂或器械配送的个人或实体,包括但不限于:制造商;分包商;普通承运商;合同承运商;航空承运商;自有标签分销商;自有品牌分销商;临时工(jobbers);经纪人,仓储和药品批发仓库;独立批发药品贸易商;零售药店。
计划策划人指州或地方政府,包括印第安部落;州或地方政府雇用的人员;或监督或管理部长声明涵盖MCM产品的管理、分发、发放、提供或使用流程的其他人员,包括制定要求,提供政策指导,提供技术或科学建议者,部长声明涵盖MCM产品设施的协助者或提供者。依据前述定义,在执行所描述的活动时,私营部门雇主或社区团体或其他“人员”,均可以视为计划策划人。
授权人指依据开具所涵盖的MCM产品所在州的法律,开具处方、管理或发放所涵盖的MCM产品的执业医护人员或经过授权的其他人士;或在卫生部部长声明中被确定为具备资质的人员类别中的人员。依据前述定义,卫生部部长可以在《PREP法案声明》中具体说明其他具备资质的人员,例如志愿人员,也在所涵盖人员之列。
《PREP法案》还界定了该法案中所指的“人”,包括个人、合伙企业、公司、协会、实体或公共或私营公司,包括联邦、州或地方政府机构或部门。所涵盖的MCM产品。[25]
所涵盖产品
相关法规对所涵盖的MCM产品有严格的限定。[26] 依据PREP法规定,“所涵盖的MCM产品”,必须是“具备资质的用于对抗大流行或流行病的相关产品”或如下文所述的“安全保障MCM产品”(security countermeasures);或依据《FD&C法案》第564、564A或564B节规定,获得紧急使用授权(EUA)的药品、生物制品或器械。
具备资质用于对抗流行病或流行病产品,是指依据《FD&C法案》定义的药物或装置,或依据《PHS法案》定义的生物制品,包括(i)制造、使用、设计、开发、改良、许可或采购用于诊断、减轻、预防、治疗或治愈大流行病或流行病,或限制大流行病或流行病可能造成的危害的产品;(ii)制造、使用、设计、开发、改良、许可或采购,用于诊断、减轻、预防、治疗或治愈由此类药品、生物制品或器械引起的严重或危及生命的疾病或状况;(iii)旨在增强此类药品、生物制品或器械的使用或效果的产品或技术。
安全对策产品(security countermeasures),是依据《FD&C法案》定义的药品或器械,或依据《PHS法案》定义的生物制品,包括(i)(a)由卫生部部长确定的优先用于诊断、减轻、预防或治疗伤害,或国土安全部部长认定为重大威胁的所有化生放核剂造成的伤害,或(b)用于诊断、减轻、预防或治疗可能导致不良健康后果或死亡的情况造成的伤害,以及可能由于服用此类药品、生物制品或器械引起的伤害;(ii)卫生部长认为属于保护公众健康必须的CMC产品。
作为所涵盖的MCM产品,具有资质的用于大流行或流行的相关产品或安全保障MCM产品,必须是依据《FD&C法案》或《PHS法案》获批;或依据《FD&C法案》第564、564A或564B节获批的相关产品。
如果具有资质的用于大流行或流行病的相关产品受到《FD&C法案》豁免,即依据药品临床试验申请(IND)或临床研究用器械(IDE)豁免被允许使用,并且是相关流程研究的对象,则也可能属于所涵盖的MCM产品。相关产品,可能会被用于诊断、减轻、预防、治疗或治愈,或限制由此类药品或器械引起的大流行或流行病伤害或严重或危及生命病症的危害。
在卫生部确定采购相关的MCM产品适用的情况下,如果可以合理地被确定相关产品十年内有资质获得批准或许可,也可以认为相关产品属于所涵盖的MCM产品。
具体到针对新冠肺炎紧急状态签发的《PREP法案声明》,依据Azar部长签发的《PREP法案声明》,所涵盖的针对新冠肺炎大流行的MCM产品,包括用于治疗、诊断、治愈、预防或减轻新冠肺炎、新冠病毒传播,或新冠病毒变异的所有抗病毒药品,以及其它所有药品、生物制品、诊断试剂、器械及疫苗,以及任何用于这类产品使用的器械,以及这类产品的所有组分或组成物质。
所涵盖的对策产品”,必须是“具备资质的对抗大流行或流行产品”或“安全对策产品”,或者是授权用于研究或紧急使用的药物,生物制品或器械,例如依据《PREP法案》、《FD&C法案》和《PHS法案》所定义的相关产品。
对配送的限定
卫生部部长可以具体说明,责任豁免仅对通过特定配送方式获得的所涵盖MCM产品有效。依据《PREP法案声明》,与(a)现行或将来的联邦合同、合作协议、捐赠、其它交易、机构间协议或谅解备忘录或其它与联邦协议有关的推荐活动,应向建议的采取的行动所涵盖的人员提供责任豁免。(b)依据具有管辖权的机构的公共卫生和医药响应而授权的活动,以在公布紧急状态声明后,处方、管理、交付、分发或发放所涵盖的MCM产品。依据相关法规的明确定义,“具有管辖权的机构”,包括联邦、州、地方和部落当局,以及代表这些政府实体采取行动的机构或组织。[27]
对于政府计划规划者,责任豁免仅适用于通过自愿手段获得“所涵盖的MCM产品”的范围内,例如(1)捐赠;(2)商业销售;(3)从联邦储备中部署所涵盖的MCM产品;(4)部署从州、地方或私人储备中捐赠、采购或以其它方式自愿获得的所涵盖MCM产品。对配送的限定,是为了阻止作为政府实体的计划规划着扣押私人库存的所涵盖产品。该条例病不适用于其它所有的所涵盖人员,包括不属于政府实体的其他计划规划者。
所针对的疾病类型、健康状况或威胁
Azar部长在签发的《PREP法案声明》中明确说明,管理和使用所涵盖的MCM产品的覆盖范围,只限于针对新冠病毒或新冠病毒变异所引起的新冠肺炎的相关产品。[28]
所涵盖产品的管理
所涵盖MCM产品的管理,指向接收者实际提供相关的MCM产品,或者直接向与公共和私营机构交付,向接收者分发和发放相关MCM产品有关的活动和决策,管理和运行MCM产品计划,或针对特定场所的相关MCM产品分发与发放的管理与运行。[29]
相关人群
依据相关法律规定,相关人群指出依据《PREP法案声明》,使用或服用所涵盖的相关MCM产品的所有个人群体。[30]
不论相关人群是否使用了相关的MCM产品或对其采用了MCM产品,相关产品的制造商和分销商均享有责任豁免权;如果相关人群使用或服用的相关MCM产品,或者相关方案规划者和授权人有足够理由认为接受者存在于相关人群中,则相关方案规划者和授权人应享有责任豁免权。
地理区域
对于所涵盖的MCM产品的管理或使用所赋予的责任豁免,没有地理区域限制。[31]
不论相关地理区域是否使用了相关的MCM产品或对其采用了MCM产品,相关产品的制造商和分销商均享有责任豁免权;如果相关MCM产品在相关指定区域使用或服用,或者相关方案规划者和授权人有足够理由认为相关指定区域存在接受者,则相关方案规划者和授权人应享有责任豁免权。
有效期限
依据相关的《PREP法案声明》,采用声明所述配送方式的所涵盖MCM产品,除了遵守相关机构的公共卫生响应和医药应对之外,责任豁免的有效期限至2024年10月1日。
根据具有管辖权的相关机构的公共卫生和医疗响应管理和使用所涵盖MCM产品的责任豁免权,从紧急状况申明开始,并持续到紧急状况申明生效的最后一天,或持续至2024年10月1日,以先到日期为准。[32]
额外的有效期限
卫生部长Azar在《PREP声明》中指出,确定增加12个月的责任豁免有效期,使得制造商可以安排处置所涵盖的MCM产品,包括制造商收回所涵盖的MCM产品,以及所涵盖的人员采取类似的相关行动,限制所涵盖的MCM产品的服用与使用。
从在相关《PREP法案声明》有效期内,从国家战略储备中获得的所涵盖MCM产品,责任豁免有效期截止于国家战略储备发放或放行所规定的服用或使用期限。[33]
MCM产品伤害赔偿计划
《PREP法案》授权建立“MCM产品伤害赔偿计划”(the Countermeasures Injury Compensation Program ,CICP),为某些因服用或使用所涵盖MCM产品而直接遭受严重身体伤害的个人或通过遗产管理人提供福利,并向某些因管理或使用涵盖对策而直接致死者的遗属提供福利。MCM产品与严重人身伤害之间的因果关系,必须得到有力、可靠、有效的医学和科学证据的佐证,才能认为个人应获得赔偿。CICP计划由卫生和公众服务部卫生资源和服务管理局(Health Resources & Services Administration,HRSA)管理,CICP计划设立免费拨入电话和官网。
《PREP法案》可以在突发公共卫生事件之前做出,并且可以为宣布突发公共卫生事件之前和之后的活动提供责任豁免。除非PREP法案声明指出需要公共卫生或其他紧急声明来触发豁免,否则根据PREP法案的豁免不需要根据第319条或其他法规单独声明。除非《PREP法案声明》具体指出需要公共卫生或其它紧急状态声明来触发豁免,否则,依据《PREP法案》的豁免,并不需要依据《PHS法案》第319条或其它法规单独声明。
《PREP法案》授权设立“所涵盖对策产品程序基金”(Covered Countermeasures Process Fund),以补偿经过认定的因依据《PREP法案》管理或使用的MCM产品直接导致遭受伤害的个人。国会必须将资金拨入相关帐户,支付相关索赔。在提出索赔要求之后,如果获得赔偿,则可以根据CICP计划向经过认定请求者提供严重人身伤害赔偿。严重人身伤害,指必须住院治疗(无论是否实际住院)或导致身体机能丧失或因残疾严重丧失身体机能的伤害。CICP计划为经过认定的受伤对策接受者支付合理和必要的医疗福利,以及因此损失的工资。某些经过认定的遗属,还可能获得死亡抚恤金,这些死亡者是由于管理或使用涵盖性对策而直接死亡的。CICP计划是最终付款人。因此,所有其它公共和私人第三方支付方应支付的金额,例如健康保险和劳工灾害补偿(workers’ compensation),都会减少给付。CICP计划实施的法律依据,请参见《美国法典汇编》第42编第110节(42 CFR Part 110 - COUNTERMEASURES INJURY COMPENSATION PROGRAM,MCM产品伤害补偿计划)。[34]
如果没有拨款用于赔偿计划,或者卫生部部长没有在240天内根据个人的要求做出最终决定,或者如果个人决定不接受赔偿,则受害个人或其代表可以提起侵权诉讼。向哥伦比亚特区地方法院提出索赔诉讼,但前提是该索赔涉及蓄意的不当行为,并且符合《PREP法案》规定的其它诉讼要求。如果获得任何赔偿,都会因为其它公共和私人第三方支付方应支付的金额而减少。对于非经济损失,例如疼痛、痛苦、身体受损、精神痛苦与丧失配偶权的裁决也很少。如果个人接受CICP的赔偿,或者没有蓄意的不当行为,则个人无权在美国联邦法院或州法院提起侵权诉讼。
《PREP法案》并未取代公共卫生领域中个人可能获得的其它某些类别的法律保护。例如,依据《联邦侵权索赔法案》(the Federal Tort Claims Act,FTCA法案)条款向美国政府提出索赔,而不是针对个别联邦雇员,这是这些雇员在其联邦雇用范围内执行任务时所犯的大多数过失或不当行为的专有补救措施。[5] 某些类型的联邦雇员,例如为公共卫生服务部门工作的医疗护理人士,可以从专门针对其机构的侵权豁免法中受益。[5] 此外,根据实际情况,某些志愿者可能有资质获得联邦或州法律的责任保护。对于这类情况,相关的《PREP法案声明》可以为特定MCM产品保驾护航。
与其它法案的交叉
在国土安全领域,作为2002年《国土安全法》(the Homeland Security Act of 2002)的一部分而制定的《通过促进有效技术促进反恐法案》(the Support Anti-terrorism by Fostering Effective Technologies(SAFETY)Act,SAFETY法案),为具备资质的反恐技术(QATTs)的卖家提供了一些责任保护。[4,35]这里的QATT是,指“为了预防、检测、确定或制止恐怖主义行为或限制恐怖主义行为可能造成的损害而设计、开发、改进、采购或出售的任何技术。”[36]
QATT产品必须由国土安全部长委托的负责科学技术事务的副部长认定。一旦获得QATT 产品认定,产品的卖家能够获得多重保护,包括(但不限于)联邦法院对其提起诉讼的专属管辖权、禁止惩罚性赔偿和连带责任,以及侵权责任上限不超过国土安全部在指定过程中确定的保险金额。当经过认定的QATT产品被证明能达到预期效果,符合卖家设定的质量标准,并能够安全地按预期使用时,可能会获得国土安全部(DHS)认证。一旦通过DHS认证,还具有其它有利条件,可以提出可推翻的推定,即卖家有权对产品责任和其他诉讼提起“政府承包商抗辩”,实质上使被告免受国家侵权诉讼。[37,38]
依据《SAFETY法案》的认定和认证而赋予的责任限制,仅适用于卖家,而卖家是唯一受诉的当事方。该法律授权的联邦诉讼理由具有排他性,“不得针对买方,买方的承包商或技术的下游用户,卖家的供应商或承包商或任何其他法人或实体提起诉讼。”因此,相关技术的用户,将从《SAFETY法案》的适用范围中受益。[39,40,41,42]
但是,法律的责任保护范围有严格限定,仅适用于已部署相关QATT的“源自恐怖主义行为,与恐怖主义行为有关或由恐怖主义行为引起的索赔。” [42] 在相关法案的适用范围内,符合恐怖主义条件的行为,必须是非法的,造成损害(包括经济损害),并使用“旨在或企图造成美国公民或机构大规模毁灭、伤害或其它损失的工具、武器或其它方法。” [40] 该豁免权不同于依据《PREP法案》的豁免权,依据《PREP法案声明》的豁免权,适用于“由对个人的管理或使用某种对等措施引起、产生或与之有关的所有索赔”。[15] 因此,对《PREP法案》涉及的承保范围的分析,应考虑该索赔是否直接与管理或使用承保的MCM产品有关,以及承保人是否遵守了声明的条件。[15,43]《PREP法案》赋予卫生部部长自由裁量权,尤其决定在《PREP法案声明》中对相关保护的所有限定。而《PREP法案声明》及其所界定的条件,激活了规约的豁免规定。[15,17]
《PREP法案》旨在通过限制与公共卫生紧急状况所需但市场机会有限的产品相关的责任风险,激励MCM产品的制造与交付。而依据《SAFETY法案》提供责任保护的目的,在于“推动与促进将能够拯救生命的防控技术的开发与部署。”[44] 为了获得依据《SAFETY法案》所规定的责任保护,MCM产品必须符合QATT的指定标准。在适用的情况下,依据《SAFETY法案》所规定的责任保护责任限制适用于反恐怖主义,作为保障国土安全的工具。《PREP法案》出发点是应对公共卫生危机,使卫生与公众服务部可以将有限的侵权行为豁免权扩展到与恐怖主义和传染病有关的防范与响应活动。
责任保护的着力点
允许使用医疗MCM产品并赋予其责任豁免的法律机制,来自不同的主管机构,并取决于不同的行政措施。但是,只要《PREP法案》的适用范围取决于具体MCM产品的紧急使用授权,来自于不同法律机制的责任保护,会形成合力。如果所涉产品未获得FDA批准,也未获批准用于临床试验,或者其预期用途与《FD&C法案》的相关要求存在差异,那么签发EUA或依据《PAHPRA法案》采取的行动,可帮助确保将相关产品成为《PREP法案声明》的“所涵盖对策”,从而保留适用的责任保护。因此,能否免除侵权责任,取决于能否以预期的方式给予产品适用的授权。
对于可能违反《FD&C法案》的行为,FDA具有行使执法自由裁量权的权限。相关的执法自由裁量权,可以延伸到相关的MCM产品。但是,对于《PREP法案》案声明所涵盖的MCM产品,仅根据《FD&C法案》行使执法自由裁量权,可能会给所提供的责任保护的可行性带来不确定性。因此,授予紧急使用授权(EUA),或依据《PAHPRA法案》紧急使用授权,可能会通过阐明MCM产品属于《PAHPRA法案声明》涉及的“所涵盖产品”,并通过在适用的情况下合法的紧急发放模式,帮助确保依据(PREP法案)所提供的责任保护。尤其在《PREP法案声明》本身确定授权管理MCM产品的其他授权人类别时,需要视紧急使用授权(EUA)或其它紧急机构的授权而定。对于“不符合FDA监管计划”的产品,如果只是在行使紧急使用授权(EUA)或《PAHPRA法案》授权的情况下,并根据相关紧急使用授权(EUA)或《PAHPRA法案》行动使用时,才可能适用于依据《PREP法案》的责任保护。[45]
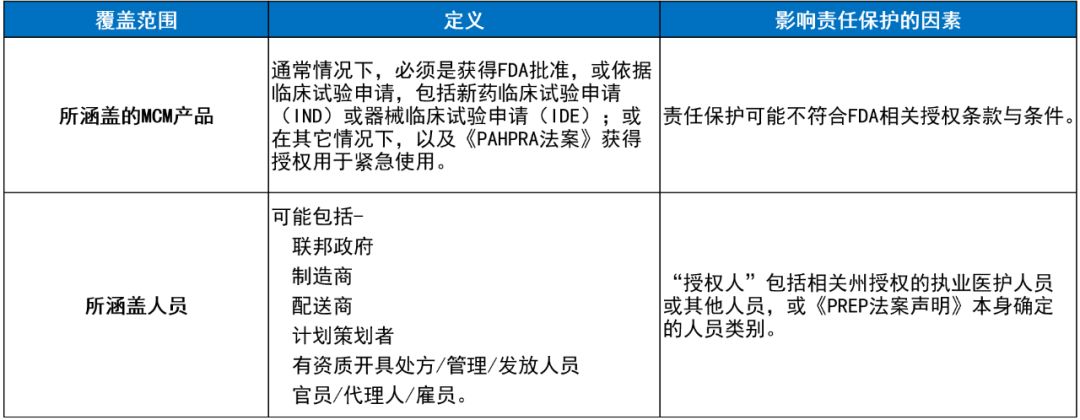
▲表5.《PREP法案》覆盖范围与紧急使用权限的交叉[44]
在大批量发放的情况下,《PAHPRA法案》提供了EUA流程之外的另一种途径,支持已批准的MCM的某些紧急使用,从而有助于解决《PREP法案》覆盖范围内的潜在漏洞。可以通过紧急使用授权(EUA)或依据《PAHPRA法案》所采取的行动,来授权以发放点(point of dispensing,POD)或其它分发方式发放已获批的MCM产品,包括在不开具处方的条件下,或由非医护人员发放,相关的授权条件,可有EUA授权条件或依据《PAHPRA法案》所采取的行动条件设定。在后一种情况下,必须在实际发生化生放核剂紧急状况下,并符合FDA紧急发放令或适用的州法律的许可。[46]
相关判例
涉及MCM产品侵权责任的相关诉讼,包括2012年Parker诉St. Lawrence县卫生局,[47] 以及2012年Kehler诉Hood。[48]
第一起诉讼中,Parker夫妇起诉St. Lawrence县卫生局,受雇于该卫生局的一位护士,在没有获得父母知情同意的情况下,无意中为一名幼儿园儿童接种了H1N1流感疫苗,原告认为被告存在疏忽和非法侵权行为(negligence and battery)。被告依据《PREP法案》规定的优先权而抗诉。下级法院驳回了被告的撤诉动议,称《PREP法案》并不保护没有知情同意情况下导致的索赔。被提请上诉,上诉法院驳回原告请求,认为联邦《PREP法案》优先于依据州法律,《PREP法案》所规定的责任豁免权范围,排除了原告起诉的被告存在的疏忽和非法侵权行为。上诉法院认为,MCM产品伤害赔偿计划提供了替代性补救措施,此外,可针对蓄意的不当行为提请联邦诉讼。法院认为,《PREP法案》豁免权的广度反映了国会的决心,即“潜在的侵权责任,必须让位于必须迅速有效地应对大流行或其它公共卫生紧急状态的需要。”该诉讼已经超过上诉期。[47]
第二起诉讼中,原告声称医生及其受雇的医院,疏忽了未成年患者的知情同意,并且未在接种疫苗之前征询专家的意见。疫苗接种会导致严重的横贯性脊髓炎,并给配偶造成丧失配偶权。被告随后以第三方产品责任/不合格为由,向制造商索赔。原告与被告双方,都没有质疑制造商受到《PREP法案》的保护,也没有声称制造商有故意的不当行为。密苏里州东部联邦地方法院驳回了对制造商的索赔。联邦法院认定,对原告的其它索赔要求没有管辖权,因此将该案退回州法院,以进一步考虑原告的索偿。[48]
结论
对涉及CBRN威胁和新出现传染病的紧急状态进行响应,奋战在第一线的个人和实体,需要了解所参与的事务的权限;同时,也要了解依照相关法案的规定的责任,为相关活动保驾护航。
依据《PREP法案》规定的《PREP法案声明》,可以对大多数结果授权的MCM产品管理和使用引起的侵权索赔提供至关重要的豁免。通过法定的责任保护,在激励医药行业创新的同时,确保利益攸关方严格依据相关授权的范围和条件来管理和使用MCM产品,免除依法守法的利益攸关方的后顾之忧。为了确保在公共卫生紧急状况下,保障MCM产品供应和有效覆盖,充分发挥MCM产品的作用,具有可预见性的法律保护措施必不可少。
免责声明:本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。
参考资料:
[1] 113th Congress. Public Law 113–5. Pandemic and All-Hazards Preparedness Reauthorization Act of 2013 (PAHPRA). Mar 13, 2013. Retrieved Feb 17, 2020 from https://www.govinfo.gov/content/pkg/PLAW-113publ5/pdf/PLAW-113publ5.pdf
[2] 116th Congress. Pandemic and All-Hazards Preparedness and Advancing Innovation Act of 2019. June, 2019. Retrieved Mar 9, 2020 from https://www.govinfo.gov/content/pkg/BILLS-116s1379enr/pdf/BILLS-116s1379enr.pdf
[3] Congress. PUBLIC HEALTH SERVICE ACT [As Amended Through P.L. P.L. 116–94, Enacted December 20, 2019] Dec 20, 2019. Retrieved Dec 22, 2019 from https://legcounsel.house.gov/Comps/PHSA-merged.pdf
[4] 42 USC 233: Civil actions or proceedings against commissioned officers or employees. Retrieved Mar 10, 2020 from https://uscode.house.gov/view.xhtml?req=granuleid:USC-prelim-title42-section233&num=0&edition=prelim
[5]28 U.S. Code § 2679. Exclusiveness of remedy. Retrieved Mar 10, 2020 from https://www.law.cornell.edu/uscode/text/28/2679
[6] CDC. Public Health Emergency Preparedness and Response Capabilities: National Standards for State, Local, Tribal, and Territorial Public Health. Oct, 2018. Retrieved Jan, 2019. Retrieved Mar 12, 2020 from https://www.cdc.gov/cpr/readiness/00_docs/CDC_PreparednesResponseCapabilities_October2018_Final_508.pdf
[7]药明康德内容团队. 美国FDA如何开展医药产品紧急使用授权?Feb 27, 2020. Retrieved Feb 27, 2020 from http://dy.163.com/v2/article/detail/F6FA2SNM05349C3I.html
[8] 药明康德内容团队. 没有医药产品紧急使用授权情况下,FDA如何开展医药产品紧急使用?Mar 3, 2020. Retrieved Mar 3, 2020 from https://www.sohu.com/a/377287975_282570
[9] 药明康德内容团队. 权威机构报告:FDA与医药商支持让临床亟需患者用上试验用药. Sept 24, 2019. Retrieved Sept 24, 2019 from https://med.sina.com/article_detail_103_2_71953.html
[10] 药明康德内容团队. 应对公共卫生紧急状态医药对策产品开发:FDA的实践与挑战. Mar 10, 2020. Retrieved Mar 10, 2020 from https://med.sina.com/article_detail_103_2_78849.html
[11] Paules CI, Eisinger RW, Marston HD, et al. What Recent History Has Taught Us About Responding to Emerging Infectious Disease Threats. Ann Intern Med. 2017 Dec 5;167(11):805-811. doi: 10.7326/M17-2496.
[12] Greg Measer. Emergency Use of Medical Countermeasures: FDA Roles and Authorities University of Arizona Regulatory Science Series. February 13, 2018. Retrieved Jan 2, 2020 from https://www.fda.gov/media/111302/download
[13] 薛波主编. 潘汉典总审定. 元照英美法词典. 法律出版社. 2003年. 北京.
[14] 119 STAT. 2818. DIVISION C-PUBLIC READINESS AND EMERGENCY PREPAREDNESS ACT, Dec 30, 2020. Retrieved Feb 20, 2020 from https://www.hrsa.gov/sites/default/files/gethealthcare/conditions/countermeasurescomp/covered_countermeasures_and_prep_act.pdf
[15] 42 U.S. Code § 247d–6d. Targeted liability protections for pandemic and epidemic products and security countermeasures. Retrieved Feb 2, 2020 from https://www.law.cornell.edu/uscode/text/42/247d-6d
[16] 42 U.S. Code § 247d–6e. Covered countermeasure process. Retrieved Feb 2, 2012 from https://www.law.cornell.edu/uscode/text/42/247d-6e
[17] Binzer P. The PREP Act: liability protection for medical countermeasure development, distribution, and administration. Biosecur Bioterr 2008;6(4):293-298. DOI: 10.1089/bsp.2008.1112
[18] Courtney B, Sherman S, Penn M. Federal legal preparedness tools for facilitating medical countermeasures use during public health emergencies. J Law Med Ethics. 2013;41(s1):22-27
[19] PHE. PREP Act Q&As. Sept 05, 2019. Retrieved Feb 12, 0202 from https://www.phe.gov/Preparedness/legal/prepact/Pages/prepqa.aspx
[20] PHE. Public Readiness and Emergency Preparedness Act. Current Declarations. Mar 11, 2020. Retrieved Mar 12, 2020 from https://www.phe.gov/Preparedness/legal/prepact/Pages/default.aspx
[21] PHE. Notice of Declaration under the Public Readiness and Emergency Preparedness Act for medical countermeasures against COVID-19. Mar 11, 2020. Retrieved Mar 12, 2020 from https://www.phe.gov/Preparedness/legal/prepact/Pages/COVID19.aspx
[22] Alex M. Azar. Determination that a Public Health Emergency Exists. Jan 31, 2020. Retrieved Feb 1, 2020 from https://www.phe.gov/emergency/news/healthactions/phe/Pages/2019-nCoV.aspx
[23] PHE. DEPARTMENT OF HEALTH AND HUMAN SERVICES Office of the Secretary. Mar 10, 2020. Retrieved Mar 12, 2020 from https://www.phe.gov/Preparedness/legal/prepact/Pages/COVID19.aspx
[24] 42 U.S.C. 247d-6d(i)(2), (3), (4), (6), (8)(A) and (B). Retrieved Mar 16 from https://www.law.cornell.edu/uscode/text/42/247d
[25] 42 U.S.C. 247d-6b(c)(1)(B), 42 U.S.C. 247d-6d(i)(1) and (7). Retrieved Mar 16, 2020 from https://www.law.cornell.edu/uscode/text/42/247d
[26] 42 U.S.C. 247d-6b(c)(1)(B), 42 U.S.C. 247d-6d(i)(1) and (7) 42 U.S.C. 247d-6b(c)(1)(B), 42 U.S.C. 247d-6d(i)(1) and (7). Retrieved Mar 16, 2020 from https://www.law.cornell.edu/uscode/text/42/247d
[27] 42 U.S.C. 247d-6d(a)(5) and (b)(2)(E). Retrieved Mar 16, 2020 from https://www.law.cornell.edu/uscode/text/42/247d
[28] 42 U.S.C. 247d-6d(b)(2)(A). Retrieved Mar 16, 2020 from https://www.law.cornell.edu/uscode/text/42/247d
[29] 42 U.S.C. 247d-6d(a)(2)(B). Retrieved Mar 16, 2020 from https://www.law.cornell.edu/uscode/text/42/247d
[30] 42 U.S.C. 247d-6d(a)(4), 247d-6d(b)(2)(C) . Retrieved Mar 16, 2020 from https://www.law.cornell.edu/uscode/text/42/247d
[31] 42 U.S.C. 247d-6d(a)(4), 247d-6d(b)(2)(D). Retrieved Mar 16, 2020 from https://www.law.cornell.edu/uscode/text/42/247d
[32] 42 U.S.C. 247d-6d(b)(2)(B). Retrieved Mar 16, 2020 from https://www.law.cornell.edu/uscode/text/42/247d
[33] 42 U.S.C. 247d-6d(b)(3)(B) and (C). Retrieved Mar 16, 2020 from https://www.law.cornell.edu/uscode/text/42/247d
[34] 42 CFR Part 110 - COUNTERMEASURES INJURY COMPENSATION PROGRAM. Retrieved Mar 20, 2020 from https://www.law.cornell.edu/cfr/text/42/part-110https://www.law.cornell.edu/cfr/text/42/part-110
[35] 107th Congress. H.R.5005 - Homeland Security Act of 2002. Nov 25, 2002. Retrieved Mar 20, 2020 from https://www.congress.gov/bill/107th-congress/house-bill/5005/text
[36] U.S. Code Part G— Support Anti-Terrorism by Fostering Effective Technologies. Retrieved Mar 20, 2020 from https://www.law.cornell.edu/uscode/text/6/chapter-1/subchapter-VIII/part-G
[37] 6 CFR § 25.5 - Obligations of seller. Retrieved Mar 20, 2020 from https://www.law.cornell.edu/cfr/text/6/25.5
[38] 24 CFR § 25.8 - Factors considered in taking administrative action. Retrieved Mar 20, 2020 from https://www.law.cornell.edu/cfr/text/24/25.8
[39] 6 U.S. Code § 441. Administration. Retrieved Mar 20, 2020 from https://www.law.cornell.edu/uscode/text/6/441
[40] 6 U.S. Code § 442 - Litigation management. Retrieved Mar 20, 2020 from https://www.law.cornell.edu/uscode/text/6/442
[41] 6 U.S. Code § 443. Risk management. Retrieved Mar 20, 2020 from https://www.law.cornell.edu/uscode/text/6/443
[42] 6 U.S. Code § 444. Definitions. Retrieved Mar 20, 2020 from https://www.law.cornell.edu/uscode/text/6/444
[43] HHS. Declaration Under the Public Readiness and Emergency Preparedness Act for Zika Virus Vaccines. Retrieved Mar 20, 2020 from https://www.federalregister.gov/documents/2018/08/07/2018-16856/declaration-under-the-public-readiness-and-emergency-preparedness-act-for-zika-virus-vaccines
[44] Charles G. Kels. Dispensing Medical Countermeasures: Emergency Use Authorities and Liability Protections. Health Secur. 2015 Apr 1; 13(2): 139–151. doi: 10.1089/hs.2014.0059
[45] Susan E. Sherman, Joseph Foster, Sonal Vaid. Emergency Use Authority and 2009 H1N1 Influenza. Biosecurity and Bioterrorism: Biodefense Strategy, Practice, and Science. Vol. 7, No. 3. https://doi.org/10.1089/bsp.2009.0040
[46] 21 U.S. Code § 360bbb–3a. Emergency use of medical products. Retrieved Jan 3, 2020 from https://www.law.cornell.edu/uscode/text/21/360bbb-3a
[47] Parker v St. Lawrence County Pub. Health Dept. 2012 NY Slip Op 07934 [102 AD3d 140]. Nov 21, 2012. Retrieved Mar 20 2020 from http://www.courts.state.ny.us/Reporter/3dseries/2012/2012_07934.htm
[48] Kehler et al v. Hood et al. Aug 14, 2011. Retrieved Mar 20, 2020 from https://www.law360.com/cases/4e49acb11d1d2e3e3b000001
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..