今日,Seattle Genetics和安斯泰来(Astellas)公司联合宣布,其 抗体偶联药物Padcev(enfortumab vedotin-ejfv),与免疫疗法pembrolizumab联合作为一线疗法,在治疗局部晚期或转移性尿路上皮癌初治患者的1b/2期临床研究EV-103中, 在中位随访时间为11.5个月时,使患者的客观缓解率(ORR)达到73%。
根据新闻稿中的统计信息,在2018年,全球估计有大约54.9万患者确诊患有尿路上皮癌,大约20万患者因此而去世。尿路上皮癌占膀胱癌的90%以上。目前,化疗和PD-1/PD-L1抑制剂是治疗膀胱癌患者的标准疗法。然而,对于对PD-1/PD-L1抑制剂产生耐药性的患者来说,他们的治疗选择非常有限。
Padcev是一款将抗Nectin-4单克隆抗体与微管破坏剂MMAE连接起来生成的抗体偶联药物(ADC)。它使用了Seattle Genetics公司独有的抗体偶联技术。Nectin-4是在多种实体瘤表面表达的细胞粘附分子,在尿路上皮癌中高度表达。这款疗法曾经获得FDA授予的突破性疗法认定和优先审评资格,并于去年12月获批上市,治疗局部晚期或转移性尿路上皮癌患者。
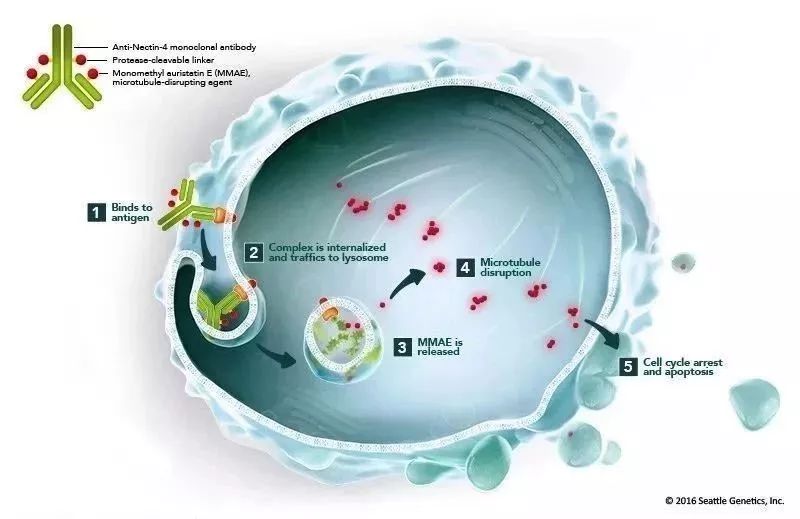
▲Padcev的作用机理(图片来源:Seattle Genetics官方网站)
在名为EV-103的1b/2期临床研究中,Padcev与pembrolizumab联合治疗无法接受一线基于顺铂化疗的晚期或转移性尿路上皮癌患者。试验结果表明,在中位随访时间为11.5个月时,该联合疗法使患者的ORR达到73%。其中, 完全缓解(CR)的患者比例为15.6%,部分缓解的患者比例为57.8%。 55%的患者缓解仍在继续,其中83.9%的患者缓解至少持续了6个月,53.7%的患者缓解至少持续了12个月。患者的中位无进展生存期(PFS)为12.3个月,12个月的总生存率(OS)为81.6%。
Seattle Genetics首席医学官Roger Dansey医学博士说:“我们对这些试验数据感到非常开心,它们为最近启动的3期临床试验EV-302提供了支持。”
Astellas肿瘤学领域高级副总裁Andrew Krivoshik医学博士说:“这些数据进一步支持我们继续评估Padcev与其他药物联合,早期治疗尿路上皮癌患者的效果。”
[1] Seattle Genetics and Astellas Announce Updated Results from Phase 1b/2 Trial of PADCEV™ (enfortumab vedotin-ejfv) in Combination with Immune Therapy Pembrolizumab as Investigational First-Line Treatment for Advanced Bladder Cancer, Retrieved February 11, 2020, from https://www.businesswire.com/news/home/20200211005337/en
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..