▎药明康德/报道
今日,Epizyme公司宣布,美国FDA肿瘤学药物咨询委员会(Oncologic Drugs Advisory Committee, ODAC)以11:0的投票结果,支持该公司开发的“first-in-class”EZH2抑制剂tazemetostat治疗不适合手术治疗的转移性/局部晚期上皮样肉瘤(epithelioid sarcoma,ES)。Tazemetostat的新药申请已经获得FDA的优先审评资格,预计在明年1月23日之前得到回复。
上皮样肉瘤是一种罕见的侵袭性软组织肉瘤,患者在20-40岁之间被确诊,通常在诊断后无法活过5年。 上皮样肉瘤在复发或转移后会变得更具侵袭性,转移性疾病患者生存期不到一年。
超过90%的上皮样肉瘤中表现为INI1蛋白表达缺失。INI1(又称hSNF5)是进化保守的“染色质重构复合物”SWI/SNF家族中的一员。这种复合物在抑癌基因的激活方面具有重要作用。INI1的突变和缺失可导致异常的组蛋白甲基化,诱发细胞的恶性转化,并且细胞的增殖会依赖于EZH2的活性。
作为组蛋白甲基转移酶,突变或过表达的EZH1/2,会抑制抑癌基因的转录活性。通过抑制EZH2,tazemetostat能够抑制组蛋白H3赖氨酸27(H3K27)的甲基化,恢复抑癌基因的表达。
Tazemetostat的新药申请是基于它在一项2期临床试验中的表现。在这项试验中,24名初治和38名复发/难治性上皮样肉瘤患者接受了tazemetostat的治疗。试验结果表明,截至2018年9月,tazemetosta的客观缓解率为15%,疾病控制率达到26%,中位总生存期尚未达到。
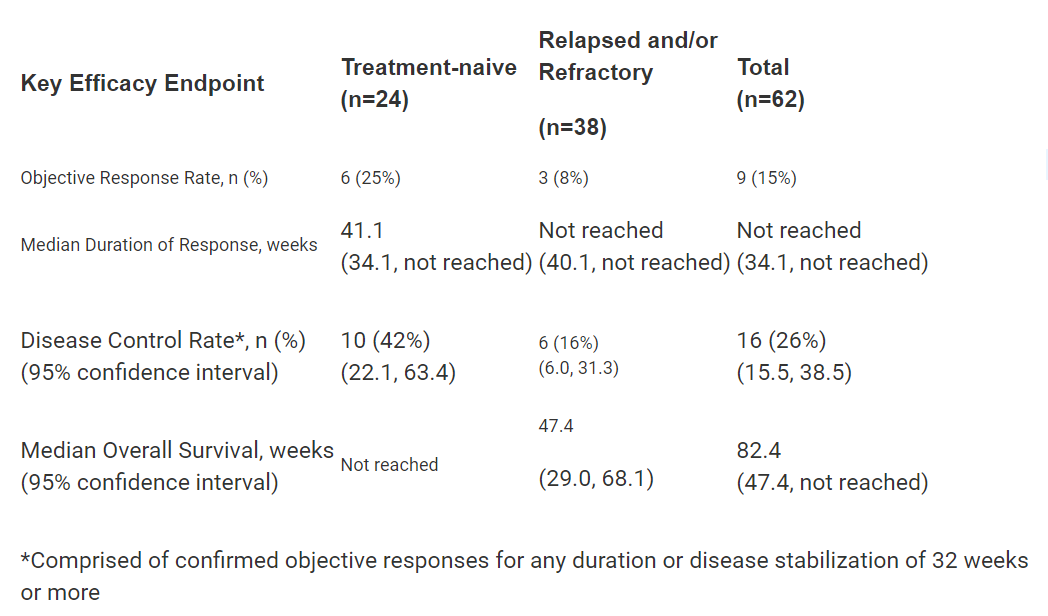
▲Tazemetostat的疗效数据(图片来源:Epizyme公司官网)
“我们非常高兴ODAC一致支持使用tazemetostat治疗上皮样肉瘤,“Epizyme公司首席医学官 Shefali Agarwal 博士说:“我相信我们已经为支持tazemetostat的批准递交了完备的数据包,我们期待与FDA继续合作完成NDA的审评。”
参考资料:
[1] Epizyme Announces FDA Advisory Committee Votes Unanimously in Favor of Tazemetostat for the Treatment of Patients with Epithelioid Sarcoma. Retrieved December 18, 2019, from https://www.businesswire.com/news/home/20191218005679/en
[2] A Phase 2, Multicenter Study of the EZH2 Inhibitor Tazemetostat in Adults (Epithelioid Sarcoma Cohort) (NCT02601950). Retrieved December 18, 2019, from http://www.epizyme.com/wp-content/uploads/2018/10/ESMO18-Cohort-5-poster_Final.pdf
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..