胰腺癌被称为“癌症之王”,目前仍是人类最致命的恶性肿瘤之一,早期通常无症状,大多数患者在确诊时都已处于晚期,只有8%的患者在确诊后5年内仍然存活。不仅传统的化疗和放疗对胰腺癌束手无策,就连革新了多种其它类型癌症治疗的免疫疗法对胰腺癌在很大程度上也是无效的。为了攻克这类癌症,科学家们一直在探究其如此“顽固”背后的原因。

图片来源:Nature
12月11日,最新发表在Nature杂志上的一篇论文中[1],来自纽约大学医学院的一个研究团队揭示了一种帮助胰腺癌细胞避免“饥饿”的机制:通过劫持被称为“巨胞饮(macropinocytosis)”的过程从周围环境中吸取营养物质。同时,研究解释了RAS基因(该基因被发现在90%的胰腺癌患者中导致癌细胞异常生长)如何发生变化来促进“巨胞饮”过程。
癌细胞通过“巨胞饮”获得的蛋白质和脂肪可被分解为用于构建新的蛋白质、DNA链以及细胞膜的氨基酸和其它代谢产物。没有这些营养资源,癌细胞就无法增殖。
在这项新研究中,纽约大学医学院的Dafna Bar-Sagi教授带领团队发现了被癌细胞用于促进“巨胞饮”过程的关键分子步骤。
具体来说,研究者们发现,RAS基因突变进一步激活了SLC4A7蛋白,而SLC4A7可使“碳酸氢盐依赖性可溶性腺苷酸环化酶(bicarbonate dependent soluble adenylate cyclase)”激活蛋白激酶A。这反过来,又会改变名为v-ATPase的蛋白质的位置:将v-ATPase发挥作用的位置从“细胞深处”(细胞内膜)转移到“细胞外膜附近”。而v-ATPase在细胞质膜起作用又会促进RAC1胆固醇依赖性质膜结合(cholesterol-dependent plasma-membrane association of RAC1)。最终,外膜附近v-ATPase的聚集以及RAC1的相关定位使得膜在“巨胞饮”期间暂时鼓泡、翻滚,形成吞噬营养的口袋(囊泡)。
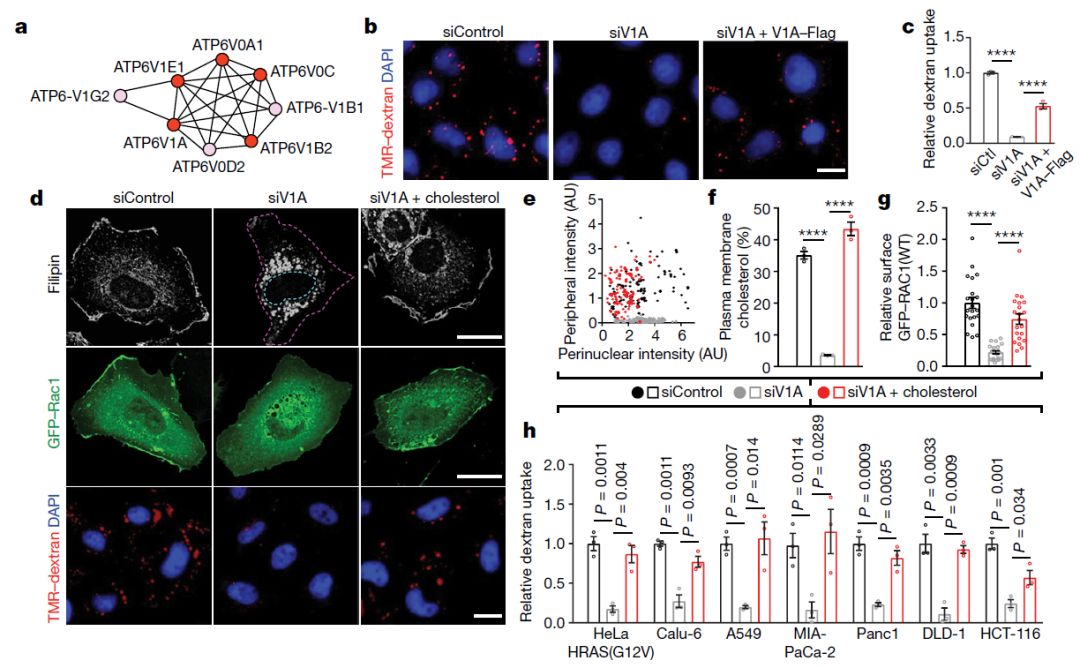
v-ATPase是RAS诱导的“巨胞饮”以及胆固醇质膜定位所需的(图片来源:Nature)
在细胞培养研究中,用SLC4家族抑制剂S0859处理突变RAS细胞,可显著降低RAS依赖性v-ATPase外膜定位,并抑制“巨胞饮”。
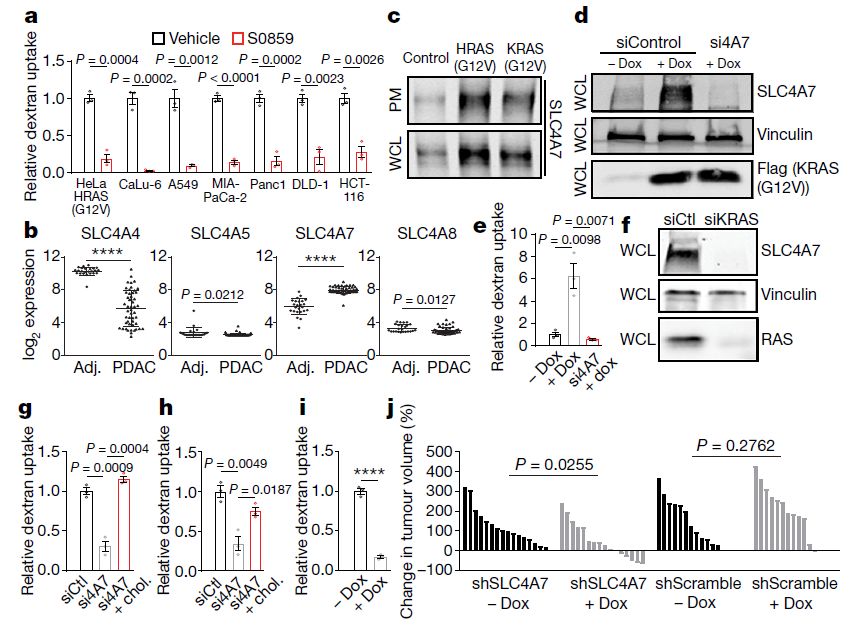
SLC4A7是RAS诱导的巨胞饮和肿瘤生长所需的(图片来源:Nature)
此外,来自人类胰腺导管腺癌(PDAC,最常见的一种胰腺癌)组织的分子数据显示,SLC4A7基因在肿瘤中的表达水平是正常附近胰腺组织的4倍。
更重要的是,研究小组发现,在小鼠中,沉默胰腺癌细胞中的SLC4A7基因可减缓肿瘤生长或缩小肿瘤。与SLC4A7基因活性正常的肿瘤相比,治疗14后,62% SLC4A7基因被沉默的肿瘤表现出生长减缓,且31%的这类肿瘤体积缩小。
Bar-Sagi教授称,他们正在寻找可能抑制SLC4A7或v-ATPase作用的候选药物,作为阻断胰腺癌细胞“巨胞饮”的一种潜在治疗手段。“原则上,这两种蛋白都是很好的抗癌靶点,因为它们与癌症生长有关,且在癌细胞表面附近发挥作用。这意味着,通过血液递送的药物可能更容易靶向它们。”她说。
小结
领域:胰腺癌
杂志:Nature
亮点:
1)来自纽约大学医学院的一个研究团队揭示了一种帮助胰腺癌细胞避免“饥饿”的机制:通过劫持被称为“巨胞饮”的过程从周围环境中吸取营养物质。
2)通过研究被癌细胞用于促进“巨胞饮”过程的关键分子步骤,他们发现,靶向SLC4A7或v-ATPase可作为阻断胰腺癌细胞“巨胞饮”的一种潜在手段。
相关论文:
[1] Craig Ramirez et al. Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis. Nature(2019).
参考资料:
1# Mechanisms help pancreatic cancer cells avert starvation(来源:NYU Langone Health)
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..