今日,安斯泰来(Astellas)和辉瑞(Pfizer)公司宣布,美国FDA批准Xtandi(enzalutamide)扩展适应症,治疗转移性激素敏感性前列腺癌(mHSPC)患者。新闻稿指出,这一批准,让Xtandi成为首款获得FDA批准,治疗三种不同形态晚期前列腺癌(非转移性和转移性去势抵抗性前列腺癌,和转移性去势敏感性前列腺癌)的口服疗法。
前列腺癌是全球男性中第二常见的癌症。而转移性激素敏感性前列腺癌意味着患者的癌症已经从前列腺扩散到身体的其它部位,不过这些患者的肿瘤仍然能对降低雄激素水平的治疗方法产生反应。据统计,在美国,2019年有大约4万人患有mHSPC。
Xtandi是一种特异性雄激素受体抑制剂,它不但能够阻断雄激素与受体的结合,而且能够抑制受体向细胞核内转移,以及雄激素受体与DNA的结合。因此它不仅仅是雄激素受体的拮抗剂,对雄激素信号通路也有抑制作用。
名为ARCHES的3期临床试验结果表明,与安慰剂和雄激素剥夺疗法(ADT)联用相比,Xtandi与ADT联用将患者出现放射学进展或死亡的风险降低61%(HR=0.39, 95% CI:0.30-0.50,p<0.0001)。同时,Xtandi+ADT治疗组中更多患者的前列腺特异性抗原(PSA)降低到无法检测到的水平(p<0.001)。这一试验结果已经在Journal of Clinical Oncology上发表。
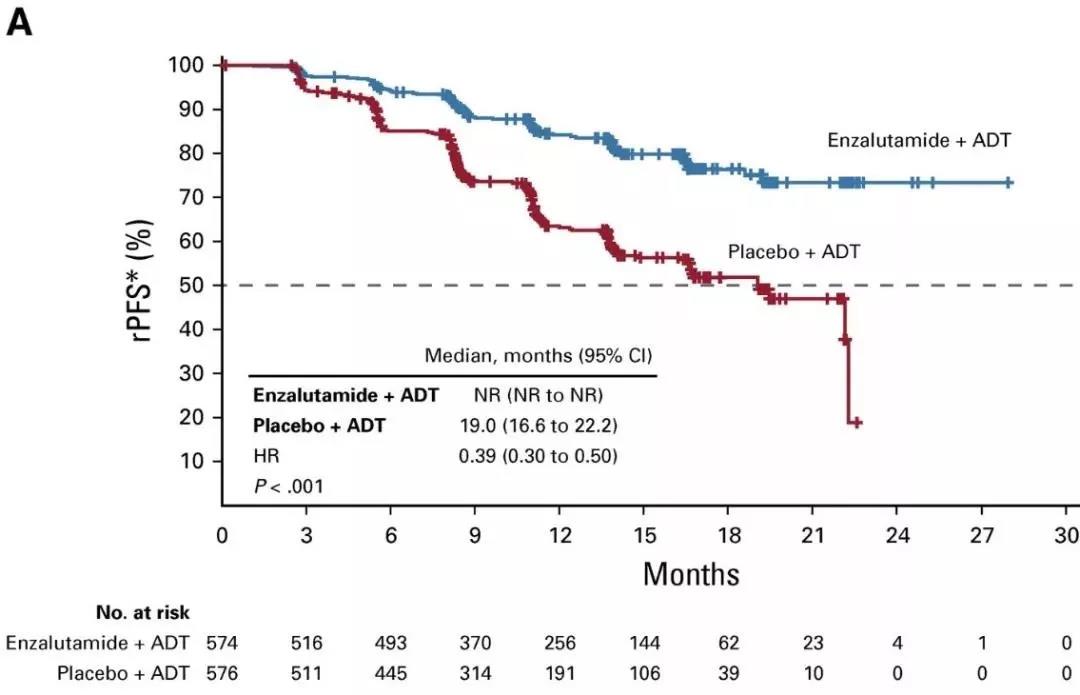
ARCHES临床试验数据(图片来源:参考资料[2])
“自从在2012年首次获批,Xtandi已经成为治疗去势抵抗性前列腺癌患者的标准疗法,用于治疗世界上超过42万名患者,”安斯泰来公司高级副总裁兼肿瘤学治疗领域负责人Andrew Krivoshik博士说:“这一批准让Xtandi能够在更早阶段治疗晚期前列腺癌患者。”
参考资料:
[1] XTANDI? (enzalutamide) Approved by U.S. FDA for the Treatment of Metastatic Castration-Sensitive Prostate Cancer. Retrieved December 16, 2019, from https://www.businesswire.com/news/home/20191216005826/en/XTANDI%C2%AE-enzalutamide-Approved-U.S.-FDA-Treatment-Metastatic
来源:药明康德
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..