近日,FDA常务副局长兼代理首席信息官Amy Abernethy博士撰文,阐述了通过患者倾听会议,让患者参与到生物医药产品研发全过程的重要性。

图片来源:FDA官网
作为一名肿瘤学家,我渴望来到FDA工作。我深知,在FDA工作,使得自己能够成为为美国许多患者的生活做出积极贡献的一份子。这些积极贡献,促进了新的医药产品开发,推进监管科学,让所有患者受益。通过与受疾病影响最大的患者以及医疗照护人员合作,对于FDA实现肩负的社会责任与担当,至关重要。
作为一位肿瘤学家,在对患者治疗中,我切身体会到,研究人员试图解决的问题,并不总是与解决患者的忧虑和担忧的目标相匹配。例如,用于支持新药获批的临床试验终点,并不总是能够瞄准患者日常体验到的病痛折磨。
对于罕见疾病,尤其如此——我们面对的现实是,对这些影响全美3000余万罕见病患者的疾病,知之甚少;95%的罕见病患者,没有任何治疗方案。最近召开的2019 年美国罕见疾病组织(the National Organization for Rare Disorders,NORD)峰会,主题是“时不我待”(The Time is Now)。在这次峰会上,罕见病患者,医疗照护人员,罕见病患者权益团体,美国卫生与公众服务部 (HHS),与FDA的领导层齐聚一堂,讨论这种错位。
作为药品监管机构,FDA认为,在涉及到患者自己的健康状况时,没有谁能够比患者和医疗照护人员,有更深刻的切身体会。当务之急是,有必要将患者和医疗照护人员的声音,融入到医药产品的整个开发过程中。从临床前研究到上市后安全监测,全程覆盖。
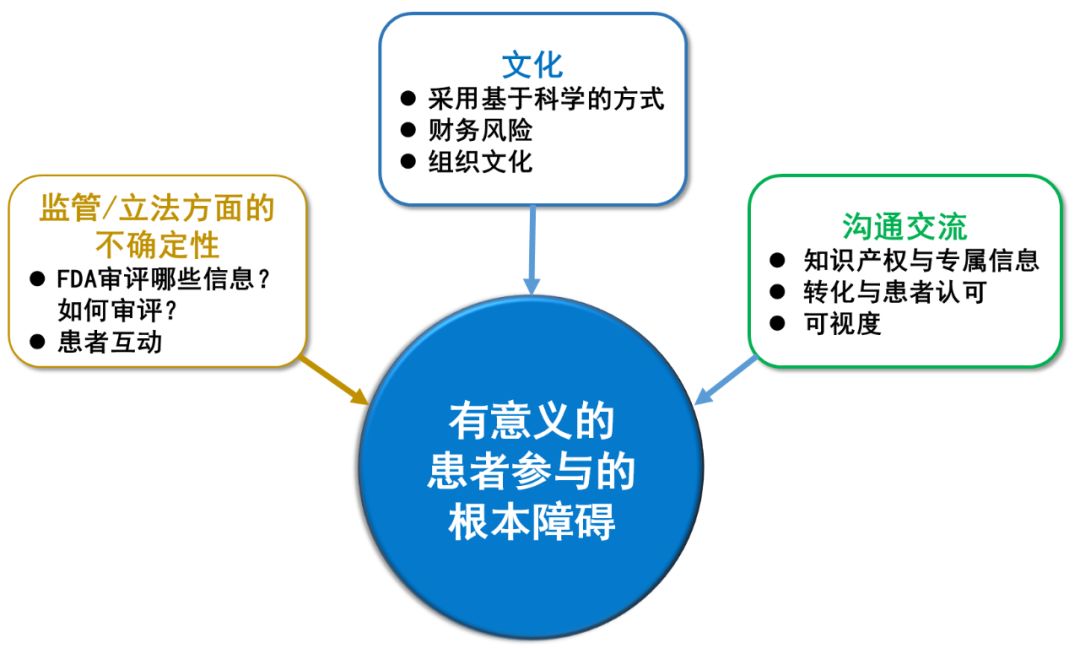
数据来源:参考资料[3] 药明康德内容团队制图
兼听则明
为了夯实FDA推动罕见疾病治疗药物开发的多项计划与举措,FDA与NORD合作,创办了罕见病患者倾听会议(the Rare Disease Patient Listening Sessions)。这些倾听会议,由局长办公室负责患者事务的工作人员协助,开始为期一年的试点。这样的倾听会议,为患者和医疗照护人员提供直接与FDA的同仁对话交谈的机会。通过具体了解特殊罕见疾病患者的切身体会,有助于FDA的同仁深入认识患者对所患疾病,亟需的治疗方案和有意义的(临床)结局。这些会议的参会者,提供了独特的视角,让大家确实了解到罕见病患者和医疗照护人员的切身感受。

来源:FDA官网
在最近的一次有关特定基因疗法的倾听会议上,FDA的审评员了解到,一些患者和照护者认为,如果眼前采取的预防性治疗有效,易于管理,就往往不乐意让自己或他们的孩子参加临床试验。其他与会者表示,如果大家能够就基因疗法的优点和风险形成共识,就会更乐意参加临床试验。
在另一次为法布里病患者和照护者举行的倾听会议上,我们了解到,现有的酶替代疗法(ERT),通常能够改善肾功能,有助于缓解疲劳。然而,与会的法布里病患者和照护者提到,现行的酶替代疗法治疗,对最为常见的胃肠道症状,并没有显著改善。通过与患者和照护者的直接接触,使FDA的同仁和其他人士认识到,解决法布里病患者胃肠道症状,比现行的酶替代疗法更重要。了解到的这些重要信息,有助于相关方面开展对法布里病的研究。
图片来源:Pixabay
这些深入见解,能够让FDA的审评员了解到,在医生的诊室以外,罕见病患者的真实生活究竟是什么样的。通过面对面地倾听患者和医疗照护人员的切身体会和见解,审评员们可以更深刻地感受到患者的切身体验,从而设身处地为患者着想。这样,在着重审查相关药品的症状管理和副作用的同时,审评员们能够对相关治疗药物对日常生活的影响以及治疗,以及临床治疗的更多方面做出权衡。这些倾听会议的重要影响在于,确实帮助FDA将罕见病患者与照护者的切身体会,放在实际工作中的首要和中心位置。作为医生,我们有时可能更加关注患者的疾病或患病器官,而没有更多地从患者的角度考虑,也没有更多关注疾病之外的患者实际生活体验。但在FDA,我们深知,在评估安全、有效的罕见病治疗药物时,我们必须将所有患者,而不仅仅是将疾病,放在我们工作的最前端。
始于足下
在过去的一年里,FDA召开了有罕见病患者、医疗照护人员患者权益团体共同参加的倾听会议。除了上述疾病和病症外,在2019年和2020年,FDA计划举办更多的倾听会议。在这些会议上,各方将要探讨的疾病和病症,还包括桑菲利波综合征和神经纤维瘤病(Sanfilippo Syndrome and Neurofibromatosis)。作为试点项目的成就,FDA着手编制相关的工作人员工作指南。这一指南将正式建立倾听会议计划,确保从倾听会议中总结出的有效流程,能够贯彻落实。
对于罕见疾病患者和医疗照护人员,这些倾听会议也是难得的学习机会。参加倾听会议,能够让患者和倡导者更好地了解FDA的监管工作,让患者体验到,在覆盖生物医学研究开发全过程的日常工作中,FDA所发挥的重要作用(从动物和细胞研究到上市后阶段)。在参加听讲会之前,与会者需要接受有关FDA和医药产品开发的教育,能够有机会集中提出对FDA有用的信息,使大家能够更有效地参与。根据与会人士的反馈,患者认为,在会上,他们有充足的时间反映自己的观点;最重要的是,他们认识到,自己发出的声音“受到重视”。与会的患者认为,能够在论坛上亲自讲述他们亲身经历,得到了FDA的关注。患者们表示,愿意再次参会,分享自己的切身体会。

图片来源:Pixabay
为了确保所有利益攸关方都能获得这些重要信息,行业申办方、患者和研究组织,可以通过访问下述网址,了解患者倾听会议网页上发布的摘要(FDA患者倾听会议网址:http://www.fda.gov/patients/learn-about-fda-patient-engagement/patient-listening-sessions)。
FDA领导层和我,将致力于将患者的声音融入到有关新治疗药物和正在开发的治疗药物的决策中。在最近参加的视频访谈中,我总结、反思可自己的体会,更加突出了FDA聆听患者体验,推动将患者的建议、意见,融入到科学与决策中的重要性。FDA坚信,罕见病患者倾听会议,是让患者确实参与到医药产品发现和开发全过程的一种重要方式。今后,FDA将继续完善该计划,向患者和医疗照护人员取经,确实了解他们切身体会;让倾听患者声音,成为医药产品开发中应该注意的优先事项。
免责声明:本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。
参考资料:
[1] FDA. FDA rare disease listening sessions. Retrieved Nov 16, 2019 from https://www.fda.gov/patients/learn-about-fda-patient-engagement/patient-listening-sessions
[2] Amy Abernethy. Patient Perspective Is Vital to FDA's Work. Nov 7, 2019. Retrieved Nov 8, 2019 from https://www.fda.gov/news-events/fda-voices-perspectives-fda-leadership-and-experts/patient-perspective-vital-fdas-work
[3] National Health Council, Genetic Alliance. Dialogue/Advancing Meaningful Patient Engagement in Research, Development, and Review of Drugs. Sept 22, 2015. Retrieved Nov 20, 2019 from https://www.nationalhealthcouncil.org/sites/default/files/PatientEngagement-WhitePaper.pdf
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..