11月10日
,第二届中国进口博览会(进博会)圆满结束。首次参加进博会的默沙东(MSD)以医药馆最大面积—800平方米展区亮相。默沙东在国内向来不太主动宣传自己,但是这次在以“创新”为主题的进博会上却摆出了高调的“排场”,背后折射出这家老牌制药巨头或许正在全球强化其创新理念。背后支撑MSD在进博会上高调亮相的基础是其明星肿瘤免疫治疗药物帕博利珠单抗(国内俗称“K药”)在过去五年的亮眼表现,以及其所展现出的巨大增长潜能。

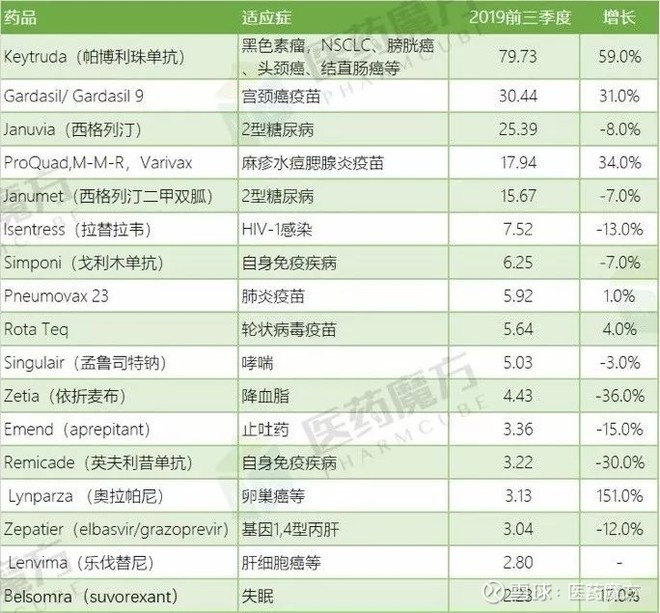
根据MSD今年10月29日公布的第三季度季报,K药第三季度全球销售额为30.7亿美元,同比增长62%,绝对值和增幅在其所有产品中一马当先。K药今年前3季度的销售收入为79.73亿美元,按照这种增长趋势,今年全年(上市第5年)的销售额有望超过110亿美元。
默沙东2019前3季度核心药品销售额(亿美元)
如果从季度销售额上对比肿瘤免疫治疗市场的其他产品,可以发现K药在市场份额上已经展现出了绝对优势,不仅将老对手O药甩得越来越远,也遥遥领先罗氏和阿斯利康的PD-L1产品,其季度增长曲线更是摆出了一种“巨龙抬头”的气势。
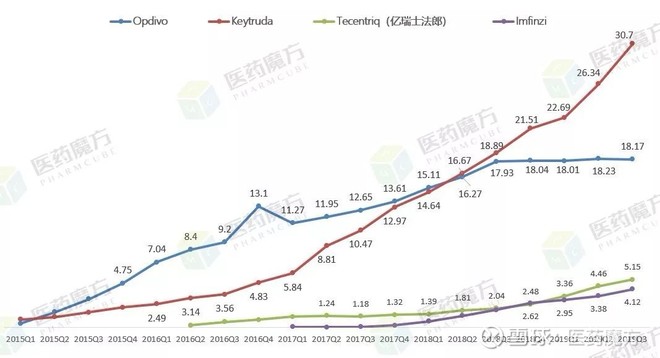
K药是肿瘤免疫治疗领域的头牌,这一点如今在业内已经没有悬念。而随着Humira开始遭遇仿制药冲击出现业绩下滑,K药正以磅礴之姿向新一代“全球药王”的权柄发起冲击。
K药今日的辉煌,有偶然,也有必然;是机遇之下的时事造英雄,也是默沙东创新研发和革新文化的有机融合;更是科学严谨的研发态度与商业眼光及大胆决策的相互博弈和互相渗透。
缘分的起点
在MSD接手前,K药辗转了多家公司,命运堪称颠沛流离。最初发现K药的是荷兰欧加农公司,但其对于将K药作为PD-1抑制剂类抗肿瘤药开发的定位并不清晰。美国先灵葆雅公司2007年收购了欧加农,但仍不看好K药的未来。即使在默沙东2009年收购先灵葆雅之后的初期,K药仍被摆在管线的陈列架上无人问津。
在当时,免疫检查点抑制剂虽然一直受到少部分科学家的推崇,但其医学和商业的潜在价值从未被科学界的主流认可。因此MSD接手后的K药也只能被束之高阁,甚至差点被低价转让给其它买家公司。K药的命运直到O药出现之后才得以扭转。
2010年,MSD获悉BMS从Medarex公司买来的PD-1抑制剂在早期临床中展示出了潜力,于是当即立断终止了关于K药的交易谈判,并由研发部门对其潜力给予重新评估,在2011年启动K药的首个I期研究,这就是后来著名的KEYNOTE-001研究。
自此,K药踏上正轨,不再“流浪”。这是K药成长史上的第一个具有里程碑意义的转折点。但不可否认,如果不是BMS接手研发O药,MSD很可能与K药失之交臂。
定位的转换
在K药的整个成长历程中,是否需要根据生物标记物来精选患者是第一个具有里程碑意义的决定。
精选患者虽然可能带来更高的药物疗效,但也意味着覆盖人群减少,而且诊疗流程会比不区分人群更复杂。因此精选患者虽然在医学理念上更正确,但往往不被商业和资本市场看好。但是,MSD的研发部门坚持了“科学至上,区分患者,给予个性化治疗方案是天经地义”的理念。
这个决策在当时并不被外界各方看好,因为看起来将会缩小K药的临床应用空间,降低它的商业价值。比如,K药最初获批二线治疗NSCLC时要局限于PD-L1表达阳性的患者(K药最初凭借KEYNOTE-001的数据被FDA批准限于TPS≥50%的人群,随后凭借KEYNOTE-010的数据拓展到了TPS≥1%的人群,覆盖患者扩大了一倍),而O药则是针对所有人群,不需考虑PD-L1表达情况。实际结果是,K药在NSCLC二线治疗市场竞争乏力,并未显示精准治疗的优势,反而因为需要检测PD-L1水平影响了临床应用,这加剧了外界对K药临床开发策略的质疑。
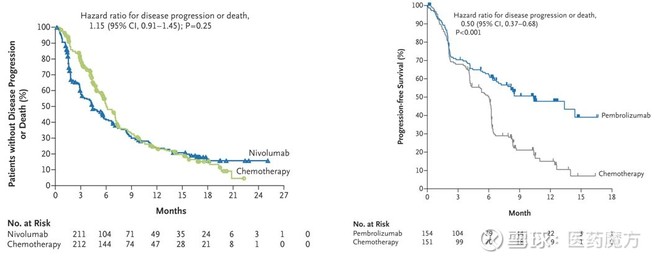
进入2016年,MSD精选人群的策略迎来了转机,让K药实现了“弯道超车”。在ESMO大会上,MSD公布了代号为KEYNOTE-024的III期临床研究结果,显示K药单药一线治疗PD-L1高表达(TPS≥50%)非小细胞肺癌(NSCLC)带来的无疾病进展生存(PFS)和总生存(OS)显著优于标准化疗方案。而就在不久之前,BMS公布O药治疗更广泛NSCLC人群(PD-L1 ≥5%)的III期临床研究(CHECKMATE-026)结果为阴性(见:爆冷!Opdivo一线治疗非小细胞肺癌III期研究失败,BMS输掉与MSD的天王山之战!)。
CheckMate-026和KEYNOTE-024研究的PFS数据
CheckMate-026和KEYNOTE-024研究的OS数据
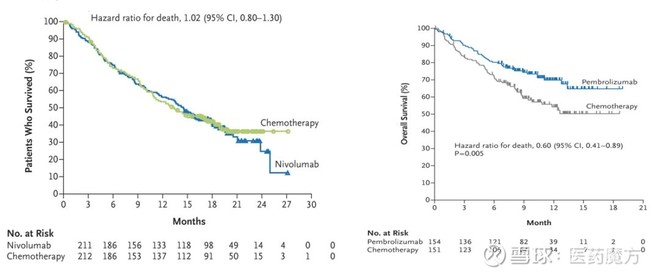
KEYNOTE-024研究结果的公布是K药成长史上的第二个里程碑,因为它让K药的心态从“不被O药甩开太远”转变为“赶超O药不是不可能”。
2016年底,美国FDA批准K药单药一线治疗PD-L1高表达的NSCLC。虽然使用人群窄,但是这个适应症仅K药一家。从此K药在一线治疗NSCLC的研发上势不可挡,在2017年,2018年和2019年被FDA接连批准联合化疗一线治疗非鳞状NSCLC(基于KEYNOTE-21G研究)、鳞状NSCLC(基于KEYNOTE-407研究),以及单药一线治疗PD-L1阳性(TPS≥1%)NSCLC(基于KEYNOTE-042研究)。
业内对于抗肿瘤药物市场成功的因素有一些不成文的共识,比如“得肺癌者得天下”、拿下美国市场,拿下一线疗法。因此,K药在美国急速开拓晚期NSCLC一线治疗适应症一举奠定了其在全球肿瘤免疫治疗领域“免疫之王”的地位。在这个过程中,O药和K药在黑色素瘤、头颈癌、肾细胞癌、肝细胞癌等领域你争我夺,齐头并进,大幅度拉开了和后入场者的差距。从适应症和市场表现上看,后来者当中目前只有罗氏T药(罗氏)在三阴性乳腺癌和小细胞肺癌领域取得了领先地位,以及阿斯利康I药凭借对III期NSCLC这个细分人群的定位占据了一席之地。
K-O大战演绎中国“速度与激情”
O药和K药的全球竞赛始于2014年,当年O药在日本、K药在美国先后获批首个适应症。2018年第二季度,K药首次单季度销量超越O药,耗时4年。而在中国市场,这个交叉产生的时间却不到一年。
2018年6月15日,O药在中国获批单药二线治疗无驱动基因突变的NSCLC,成为国内首个获批上市的PD-1单抗,开启了中国肿瘤免疫治疗之路,创建了中国肿瘤治疗的一个里程碑。35天后,K药于2018年7月20日获批一线治疗失败的不可切除的恶性黑色素瘤。
2018年8月31日,O药宣布正式上市,而K药于其后的9月20日宣布上市(差距从35天缩小到了20天),并几乎同步推出患者援助项目“生命之钥”。所以,与全球市场不同,在中国,KO药的竞争从一开始就是争分夺秒。
截至今日,K药在中国已斩获3个适应症(两个NSCLC一线治疗,一个恶性黑色素瘤二线治疗);另有联合化疗一线治疗鳞状NSCLC的适应症已于2019年11月6日通过CDE技术评审,目前在等待最后行政审批,预计在11月中旬获批。一旦获批,K药将和美国一样,包揽了三个一线肺癌适应症。
K-O在中国申报获批的适应症

O药在率先获得NSCLC的二线适应症后,也快速递交了头颈部鳞癌的适应症申请。该适应症在近期获批,让O药在国内也拓展了适应症,并昂首进入一个缺乏有效治疗手段的瘤种。
至此,O药和K药在中国的肿瘤领域开创了很多先河,为造福中国患者做出了很多开拓性的创新。两家公司在中国的PD-1三期注册临床数量也分别达到17项(K药)和14项(O药)。相信未来在中国患者需要的肿瘤类型上将有更多的适应症问世。
PD-1市场的中国魔方
在美国市场,PD-1市场的魔方已经越玩越大。美国FDA共批准K药22个适应症,治疗15种不同的恶性肿瘤,以及所有有微卫星不稳定/错配修复缺陷(MSI-H/dMMR)的恶性肿瘤(不限发病部位)。O药、I药、T药也都有多项临床研究正在进行,包括O药和I药最近也宣布了多项一线治疗NSCLC的III期临床研究取得阳性结果,即将在医学会议上发布结果,并和全球的药监机构分享。而在中国市场,PD-1市场的魔方才刚开始玩,而且能玩得多大,还有待时日。

K药,以及所有PD-1/PD-L1厂家,在中国面临的挑战就是肿瘤免疫治疗市场的复杂性。因为除了全球竞争的K、O、T、I之外,中国还是全世界唯一一个同时拥有3家本土企业开发的PD-1产品上市的国家,而且未来还有可能会更多。K药对中国市场的统治力能否像全球市场那样明显还难以做出结论,但能确定的是,对于中国这个全球第二大医药市场,任何一家企业都不会拱手让人。此次进博会上默沙东的高调亮相,似乎也是默沙东日趋重视中国市场并渴求在中国市场维护其全球“免疫之王”的一个体现。
随着肿瘤领域资深玩家罗氏和阿斯利康的PD-L1单抗即将加入中国战场,医生口中的“K-O-I-T”将展开一场激烈的免疫之战,与国内的本土原研创新企业共同玩转PD-1的魔方,一起书写肿瘤免疫治疗的“神奇”篇章。大战之余,也将造福中国的肿瘤患者






