“做就要做创新药!” 信达生物董事长俞德超在接受媒体采访时曾表示,中国的生物药不可能永远跟着别人跑,虽不能即刻做到领跑,起码应该逐渐跟国外制药企业并跑。
近年来,创新药已经成为我国医药行业的关键词,涌现了一批创新药企业。2018年药审中心批准了9个国产1类创新药,创历史新高。近年来批准的国产创新药中不乏代表性产品,如紧随世界步伐的三款国产PD-1单抗,中国首发全球新药罗沙司他,中国自主研发的First in Class药物本维莫德等,这些都是国内创新药企业不懈努力的关键成果。
百济神州中国区总经理兼公司总裁吴晓滨说,“我相信五到十年的时间里,(生物医药行业)让全世界民众受益的几个全球巨头将来自中国。我不知道是哪些公司,但他们将是中国企业。“
在医药产业加速发展和变革迭起的时期,人们都在期待看到”中国的基因泰克“,甚至”中国的辉瑞“、”中国的罗氏“,当市场空间足够大,以及市场环境日渐成熟,包括政策指引在不断完善,孕育未来的世界级药企的条件已在形成中。
政策先行 三驾马车加速创新药审批
全球创新药市场规模超3万亿,中国作为全球第二大医药市场,从国家政策层面来看,国家机关连续发文,为创新药行业发展打下政策基础;资本市场方面,港股和科创板的接连开放为国内的创新药企业带来了更多的资金来源;国际接轨方面,中国加入ICH(国际人用药品注册技术协调会)直接将中国的创新药行业与国际串联,将国产创新药带到了更大的舞台上。
2015年8月,国务院印发的国发[2015]44号《关于改革药品医疗器械审评制度的意见》(下称44号文件)正式拉开了国内创新药改革发展的大幕。
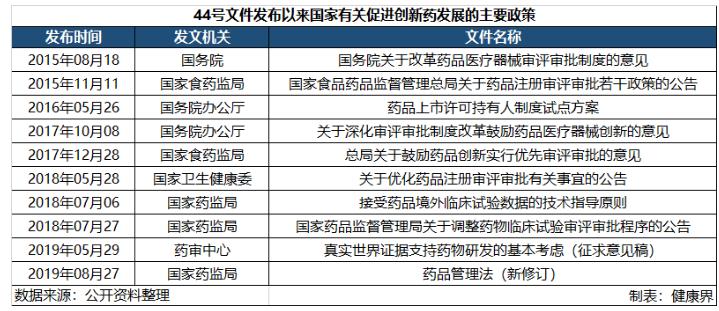
44号文件发布之后,厅字[2017]42号《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(下称42号文件)再次强调了44号文件中提到的内容,尤其是“促进药品创新和仿制药发展”、“改革临床试验管理”、“加快上市审评审批”、“加强药品医疗器械全生命周期管理”等几个要点。
而如今回头看来,44号文件和42号文件对于今年最新修订的《药品管理法》也起到了统领全局的作用,文件中提到的几大要点,在经过时间的验证后,最终成为正式的法律法规。
除了从概念上强调鼓励创新药行业发展之外,在近几年的医药新政中,从临床审批加速、药品审评审批加速和药品上市许可持有人制度上也可看出相关部门用实际行动促进行业发展。
变化一:临床审批从18个月锐减为2个月
在默示许可制度出台前,国内从开始申报到最后拿到批件临床试验审批一般要18个月左右。同一时期,澳大利亚审批时间是5天,美国、韩国是1个月,新加坡是1-2个月,欧盟是3个月,印度、俄罗斯是3-4个月。
而且这18个月中,实际审批的时间大概就只有两个月,其余时间都花在各种不必要的流程中。据递交过药品审批的人员介绍称,报药审中心审批之前,先要报省局审核;报到药审中心之后还要排队,短则数月,长则一年;审评之后还不能直接上临床,药审中心的审评报告要转到注册司审查,注册司审查之后批件还要转到省局走内部程序,几经周转到了企业手上,又耽误了几个月时间。
所以临床试验审批一直是我国创新药企业长期以来心头的痛。
44号文发布后,CFDA(现NMPA)积极响应,并迅速在2015年底出台了《国家食品药品监督管理总局关于药品注册审评审批若干政策的公告》。其中将仿制药的生物等效性试验由审批制改为备案制,首先在仿制药上进行临床试验审批提速的尝试。
2018年7月27日,药审中心发布2018第50号文件《国家药品监督管理局关于调整药物临床试验审评审批程序的公告》其中正式说明:自受理缴费之日起60日内,未收到药审中心否定或质疑意见的,申请人可以按照提交的方案开展临床试验。
不仅政策上跟进迅速,药审中心在执行上也毫不含糊。
2018年11月5日,CDE官网主页热点栏目中,增加了“临床试验默示许可公示”一栏,并在当日公布了8个获默许的受理号,此时距50号文发布才刚刚过去了三个多月的时间。这也标志着我国的临床试验申报程序正式进入默示许可时代。
变化二:上市审批加速,建立优先审评机制
2015年9月,等待审评审批的药品注册申请达到了近22000件的高峰。国务院的44号文件一经颁布,在政策推动下,国家食药监也在年底发布了更具体的政策指向,要求对八大类药品实现单独排队,加快审评审批。药审中心开始加速消化此前积压的大量药品申请,到2017年12月,待审数量已经从22000锐减到4000件。
2017年12月,CFDA发布《总局关于鼓励药品创新实行优先审评审批的意见》,在其中再次对整体药品优先审评的落地方式进行了明确的说明,包括优先审评审批范围、优先审评审批程序和工作要求等落地过程中的关键问题,并对审评流程进行了明确的时间规定,保证优先审评审批工作高效有序进行。
临床试验审批加速和药品审评审批加速共同推动了药品全流程审批加速,让创新药不再苦于缓慢的审评审批效率。这对于本就研发投入大,耗时长的创新药行业来说,无疑是一针强心剂。
变化三:药品上市许可持有人制度,明确责任主体
在2015年修订的《药品管理法》中,药品注册制度仍然是上市许可与生产许可相结合。也就是说,药品批准文号只颁发给具有《药品生产许可证》的生产企业。没有生产能力的企业和机构从基本条件上就无法获得药品批准文号,技术创新无法与最终市场收益直接挂钩,影响基础研发者们的积极性。
于是在2016年的5月26日,国务院办公厅发布《药品上市许可持有人制度试点方案》。《方案》中指出,药品上市许可持有人可以“委托药品生产企业生产”,也可以“委托药品经营企业经营”。上市许可持有人只需要在药品的生产流通过程中进行监督,并保证药品的可追溯即可。
这一制度彻底打破了我国此前研产销一体化的僵硬格局,让各个环节上的企业可以进行自由组合,各尽其职,提升药物创新效率。
创新药企的机会和困惑
过去的五年是中国创新药产业加速发展的五年。
尤其在2018年,CDE共批准了9款国产创新药进入市场,创历史新高。国家的政策在这些新药的获批中起到了辅助作用,但是更重要的还是坚持创新研发的中国创新药企业。
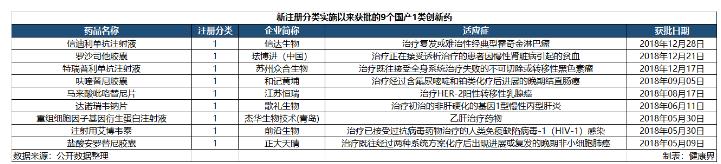
9个获批创新药中,抗肿瘤药占了5个,可以看出,国内顶尖药企对抗肿瘤药物的研发的不遗余力。
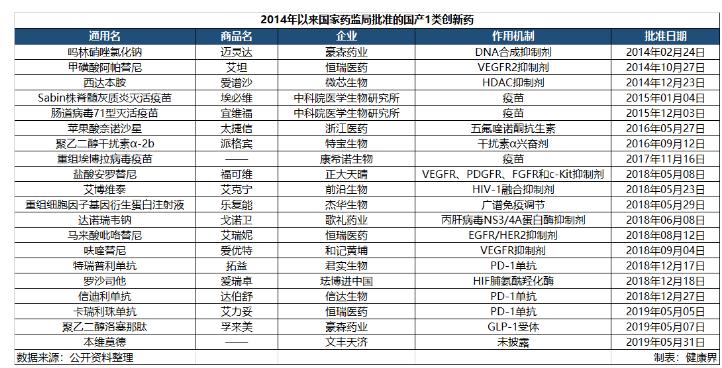
多年来,全球制药商几乎垄断着创新药物在世界各地包括中国市场占有率,而百济神州等本土企业显然希望打破这一局面,从它们手中夺取更大的市场份额。
这些国内企业已经形成了国际医药行业的一股新势力,让中国的创新药产业从跟跑到并行,未来还将继续发力,冲入领军行列。
经过数年奋力耕耘,国内最早一批创新药研发企业的自主研发项目在2018年进入收获期。
2018年12月,国家信息中心、中国经济信息网发布《2019年医药行业发展报告——展望篇:严控费、降药价,创新药、优质仿制药将脱颖而出》指出,国内创新药进入新的发展阶段,迎来初步收获期。
但对于这些从事创新药研发的企业来讲,如何真正实现商业化落地还是一个新的课题。
歌礼董事长吴劲梓在接受药明康德专访时提到:“目前国内涌现了非常多从事创新药研发公司,但真正完成产品研发走到商业化阶段的屈指可数。我们的创业者们多数都是科学家出身,做研发非常在行,但商业化的经验相对要欠缺很多。因此,对于很多海归创业企业而言,商业化阶段的挑战也许更大。对歌礼而言,戈诺卫获批上市只意味着这个产品的研发告一段落,而市场的挑战才刚刚开始。”
从歌礼的商业化进展来看,歌礼与华润医药于去年(2018年)6月宣布在商业分销渠道和终端服务等方面进行全面战略合作,提前为戈诺卫的上市做准备。
上市后,戈诺卫先在天津获得突破,进入天津医保按人头付费试点;之后在《绍兴市丙型肝炎防治工作提升行动方案》中,成为唯一获得财政补助的小分子直接抗丙肝病毒药物。
据吴劲梓介绍,歌礼早在两年前就开始筹建商业化团队,到现在已经招募了150位的专业人员,基本上都有在跨国企业从事肝病药物销售的经验,这对于快速推广戈诺卫起到了非常大的帮助作用。
另一家企业百济神州也已提前布局,先是获得了新基公司的三款已上市肿瘤药在中国的独家商业化权益,开始了实质性的产品商业化运营;之后吸引了跨国药企中国掌门人吴晓滨,助阵其全球商业化运作。
可预见的是,在多方因素共同促进下,研发实力突出、新药创制能力强的医药企业将脱颖而出。未来,如何进行商业化布局,推进全球化战略,或将是中国创新药企成长为全球性大型药企的关键所在。
科创板利好 国内创新药迎投资机遇期
生物医药产业是科创板重点扶持的六大产业之一,科创板的设立有望进一步点燃二级市场医药投资的热情。
具体来看,科创板对医药行业的影响主要体现在两个层面:
一方面,科创板助力行业加大研发投入,利好整个创新药产业链。研发型药企需要资金进行临床研究,在科创板融资成功将推动自身研发,加速产品业绩兑现。同时,行业研发投入增大有利于产业链上下游发展,研发外包行业(CRO/CMO)也因此受益。
另一方面,大量研发药企上市科创板有助于重塑行业估值体系。过去A股医药企业估值和公司当期经营表现十分相关。随着科创板许多未盈利的研发型药企上市,A股投资者可能也需要和纳斯达克投资者一样,根据公司的研发产品管线给予公司合理的估值。同时,这样一个估值转变的过程也会让投资人重新审视已经上市A股的企业,对已上市的医药公司进行资产重估。
银华科创主题基金经理唐能认为,科创板为生物科技公司和投资人提供了一次“双赢”的机会。以纳斯达克为例,纳斯达克医疗保健类公司数量最多,其中超过80%公司2018年未盈利,纳斯达克为这些初创公司的融资提供极大便利;另一方面,初创高科技公司的成长性更好,1995年至今,纳斯达克指数表现明显优于纽交所指数。
“未来,随着政策的进一步深入,医改正在步入深水区,为真正实现医药分家做最后的准备,未来研发创新、消费升级、制造升级将成为行业长期趋势。”唐能如是说。
四大要素助国内企业布局创新药市场
中国市场一些特有的大环境优势,提供了合适培育孵化生物制药企业的土壤。但同时需要注意的是,创新药企也面临几大挑战。
第一,如何在质量把控上做到既快又好。既能快速推进多项实验的同时,又能确保临床研发和商业化生产等环节的质量。
第二,如何在规模扩张的同时做好人才储备。如何培育内部人才梯队充分支持临床研发和产品商业化,成为诸多国内药企的一大难题。
第三,如何避免扎堆竞争。国内医药企业目前仍多处于渐进式创新阶段,多以较为成熟的机制作和靶点为起步,导致一些领域和靶点出现扎堆投入,实际市场回报可能低于预期,从而影响创新的持续投入。
麦肯锡医药咨询团队给出建议,对于国内创新药企业来说,应在以下几方面进行考量,具体为:
首先,重视中长期的管线布局。对于创新药企业来说,创新是企业取得长期发展的根本要义,企业应思考:在什么时间节点从渐进式发展想跨越式创新迈进;围绕疾病领域、技术平台、研发阶段、资金来源等多个维度,如何布局管线并针对性地建设相关能力。
其次,着眼产业链的能力延伸。随着产品相继获批上市,产业链上下游的能力延伸将成为打造企业护城河和差异化竞争的关键,如已有产品的商业化和生产能力,以及早期阶段的研发能力等。
再次,完善组织架构管控体系。随着人员规模的扩张和研发进程的不断推进,创新药企业在组织架构和管控贡体系方面需投入更多精力,建立起适应规模化企业发展新阶段的规范化机制。
最后,升级人才队伍引育用留。创新药企业应着力吸引全球顶尖人才充实关键岗位,为领军人物提供施展拳脚的空间。此外,企业还应投入更多精力培养技术骨干和拥有领导潜力的各级人才,通过有竞争力的激励机制来保证人才梯队的健康稳定。
来源:健康界 作者:苏浩
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..