(健康时报网端部记者 孔天骄)在收到上交所问询函后9天后,步长制药发布公告称:经自查,丹红注射液不存在质量问题。

步长制药回复公告
步长制药于5月12日收到上海证券交易所的《关于对山东步长制药股份有限公司2018年年度报告的事后审核问询函》。公告要求披露公司业务经营及模式、销售费用、业务毛利率及中药注射剂的行业政策风险等情况。
5月21日,对于上交所问询函中的问题,步长制药发布《关于上海证券交易所对公司2018年年度报告的事后审核问询函的回复公告》,称:经公司自查,丹红注射液不存在媒体所报道的不良反应情况及质量问题。
公告中的数据显示,丹红注射液近三年的销售量、收入、毛利率均出现了不同程度的下降。
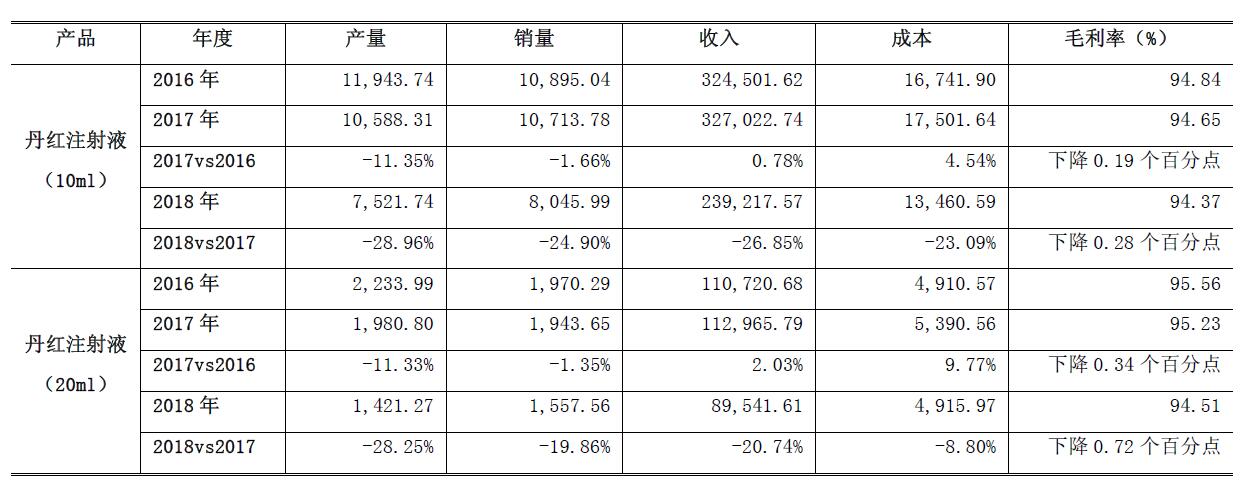
丹红注射液近三年财务数据(单位:万支/万元)
记者从公告中了解到,丹红注射液(10ml)2018年的销量为8045.99万支,收入为23.92亿元,比2017年分别下滑了24.9%、26.85%。丹红注射液(20ml)2018年销量为1557.56万支,收入为8.95亿元,比2017年分别下滑了29.86%、20.74%。
近年来,丹红注射剂多次被媒体曝出存在不良反应。公告中显示,截止2018年末,丹红注射液已被湖南、江西、安徽、云南等多个省市卫计委、公立三甲医院纳入重点监控名单,累计31次。
步长制药称,经公司自查,丹红注射液不存在媒体所报道的不良反应情况及质量问题。丹红注射液是由公司子公司山东丹红制药有限公司生产的中药注射剂,经符合国家要求的上
市前研究获准上市,2002年11月30日取得药品注册证。
公告称,一直以来,步长制药持续对丹红注射液进行全生命周期的研究,包括但不限于丹红注射液质量再评价研究、丹红注射液安全性研究、丹红注射液有效性研究等。自2009年起,公司联合研究机构,依托国家课题,分别与河南中医学院第一附属医院、山东省药品不良反应监测中心合作,对丹红注射液开展了上市后的医院集中监测安全性研究。共观察了4万余例使用丹红注射液的住院患者,结论表明丹红注射液引起的不良反应属于偶发、罕见型,停药或处置后均可缓解、消除,未观察到严重不良反应。
步长制药称将持续对丹红注射液进行上市后再评价及强化临床用药的规范性。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..